よむ、つかう、まなぶ。
「医療機器及び体外診断用医薬品のリスク管理計画の策定及び公表について」の一部改正について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00011.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和4年度第1回 7/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
記
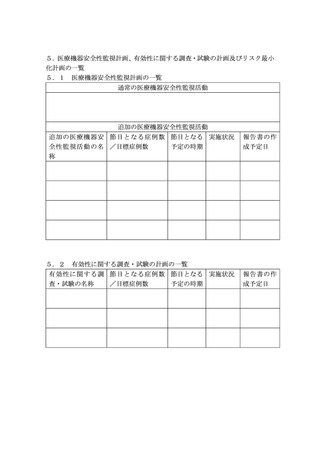
第1 医療機器等リスク管理計画の作成及び提出について
1.医療機器等リスク管理計画の作成について
GVP省令第9条の3に規定する医療機器等リスク管理計画は、別紙様式により作成すること。
2.承認申請時の医療機器等リスク管理計画の案の提出について
医療機器の承認申請に当たっては、
「医療機器及び体外診断用医薬品の製造販売承認に係る使用成績
評価の取扱いについて」
(平成 26 年 11 月 21 日付け薬食機参発 1121 第 44 号厚生労働大臣官房参事官
(医療機器・再生医療等製品審査管理担当)通知)の記の第1の1(3)に示す製造販売後調査等基本
計画書の案を提出することとしているが、医療機器等条件付き承認制度に該当する医療機器又は体外
診断用医薬品においては、製造販売後調査等基本計画書に代えて、別紙様式により作成した医療機器等
リスク管理計画の案を提出すること。
3.医療機器等リスク管理計画及び製造販売後調査等実施計画書の提出について
(1)上記2により、承認申請時に、医療機器等リスク管理計画の案を提出した場合にあっては、
「新医
療機器の再審査に係る製造販売後調査等基本計画書等について」
(平成 22 年 12 月 24 日付け薬食機
発 1224 第1号厚生労働省医薬食品局審査管理課医療機器審査管理室長通知)の3に基づく製造販売
後調査等基本計画書に代えて、医療機器等リスク管理計画を提出すること。承認後速やかに医療機器
等リスク管理計画及び追加のリスク最小化活動として医療従事者及び患者向けに作成・提供する資
材を公表することが望ましいことから、提出は、独立行政法人医薬品医療機器総合機構(以下「総合
機構」という。
)における確認期間を考慮して、対象となる医療機器の承認に係る審議又は報告が行
われる薬事・食品衛生審議会医療機器・体外診断薬部会の終了後速やかに行うこと。なお、特段の理
由により、医療機器等リスク管理計画の提出に時間を要する場合であっても、遅くとも販売開始予定
時期の1か月前までに提出すること。
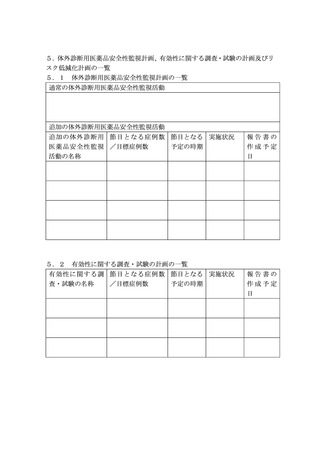
(2)製造販売後調査等実施計画書は、別添に掲げる事項を記載し、原則として調査又は試験の開始予定
時期の1か月前までに、医療機器等リスク管理計画書の添付資料として提出すること。なお、体外診
断用医薬品については別添を参考に必要な事項を添付資料としてまとめ、提出すること。
(3)提出方法は、総合機構審査業務部業務第二課(kikiann-madoguchi@pmda.go.jp)宛に電子メールに
より提出すること。提出資料は、テキストベースのPDFファイルとし、コピープロテクトは施さな
いこと。
4.医療機器等リスク管理において新たに安全性の懸念が判明した場合
医療機器等リスク管理において、新たな安全性の懸念が判明し、医療機器等リスク管理計画を変更
する場合の医療機器等リスク管理計画の提出時期や内容については、個別に総合機構に相談すること。
5.その他
上記4の場合を含め、医療機器等リスク管理計画の変更に当たっては、軽微な変更を除き、最新の医
療機器等リスク管理計画を総合機構に提出すること。提出に当たっては、変更の履歴欄に変更内容の概
第1 医療機器等リスク管理計画の作成及び提出について
1.医療機器等リスク管理計画の作成について
GVP省令第9条の3に規定する医療機器等リスク管理計画は、別紙様式により作成すること。
2.承認申請時の医療機器等リスク管理計画の案の提出について
医療機器の承認申請に当たっては、
「医療機器及び体外診断用医薬品の製造販売承認に係る使用成績
評価の取扱いについて」
(平成 26 年 11 月 21 日付け薬食機参発 1121 第 44 号厚生労働大臣官房参事官
(医療機器・再生医療等製品審査管理担当)通知)の記の第1の1(3)に示す製造販売後調査等基本
計画書の案を提出することとしているが、医療機器等条件付き承認制度に該当する医療機器又は体外
診断用医薬品においては、製造販売後調査等基本計画書に代えて、別紙様式により作成した医療機器等
リスク管理計画の案を提出すること。
3.医療機器等リスク管理計画及び製造販売後調査等実施計画書の提出について
(1)上記2により、承認申請時に、医療機器等リスク管理計画の案を提出した場合にあっては、
「新医
療機器の再審査に係る製造販売後調査等基本計画書等について」
(平成 22 年 12 月 24 日付け薬食機
発 1224 第1号厚生労働省医薬食品局審査管理課医療機器審査管理室長通知)の3に基づく製造販売
後調査等基本計画書に代えて、医療機器等リスク管理計画を提出すること。承認後速やかに医療機器
等リスク管理計画及び追加のリスク最小化活動として医療従事者及び患者向けに作成・提供する資
材を公表することが望ましいことから、提出は、独立行政法人医薬品医療機器総合機構(以下「総合
機構」という。
)における確認期間を考慮して、対象となる医療機器の承認に係る審議又は報告が行
われる薬事・食品衛生審議会医療機器・体外診断薬部会の終了後速やかに行うこと。なお、特段の理
由により、医療機器等リスク管理計画の提出に時間を要する場合であっても、遅くとも販売開始予定
時期の1か月前までに提出すること。
(2)製造販売後調査等実施計画書は、別添に掲げる事項を記載し、原則として調査又は試験の開始予定
時期の1か月前までに、医療機器等リスク管理計画書の添付資料として提出すること。なお、体外診
断用医薬品については別添を参考に必要な事項を添付資料としてまとめ、提出すること。
(3)提出方法は、総合機構審査業務部業務第二課(kikiann-madoguchi@pmda.go.jp)宛に電子メールに
より提出すること。提出資料は、テキストベースのPDFファイルとし、コピープロテクトは施さな
いこと。
4.医療機器等リスク管理において新たに安全性の懸念が判明した場合
医療機器等リスク管理において、新たな安全性の懸念が判明し、医療機器等リスク管理計画を変更
する場合の医療機器等リスク管理計画の提出時期や内容については、個別に総合機構に相談すること。
5.その他
上記4の場合を含め、医療機器等リスク管理計画の変更に当たっては、軽微な変更を除き、最新の医
療機器等リスク管理計画を総合機構に提出すること。提出に当たっては、変更の履歴欄に変更内容の概