よむ、つかう、まなぶ。
「医療機器及び体外診断用医薬品のリスク管理計画の策定及び公表について」の一部改正について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00011.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和4年度第1回 7/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添
「医療機器及び体外診断用医薬品のリスク管理計画の策定及び公表について」 新旧対照表
改
現
正 後
行
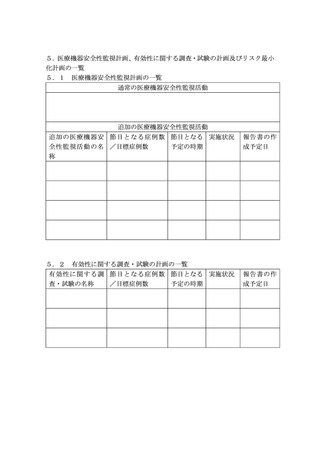
第1 医療機器等リスク管理計画の作成及び提出について
第1 医療機器等リスク管理計画の作成及び提出について
1.・2. (略)
1.
・2. (略)
3.医療機器等リスク管理計画及び製造販売後調査等実施計画書の提出に 3.医療機器等リスク管理計画及び製造販売後調査等実施計画書の提出に
ついて
ついて
(1)上記2により、承認申請時に、医療機器等リスク管理計画の案を提出 (1)上記2により、承認申請時に、医療機器等リスク管理計画の案を提出
した場合にあっては、
「新医療機器の再審査に係る製造販売後調査等基本
した場合にあっては、
「新医療機器の再審査に係る製造販売後調査等基本
計画書等について」
(平成 22 年 12 月 24 日付け薬食機発 1224 第1号厚生
計画書等について」(平成 22 年 12 月 24 日付け薬食機発 1224 第1号厚
労働省医薬食品局審査管理課医療機器審査管理室長通知)の3に基づく
生労働省医薬食品局審査管理課医療機器審査管理室長通知)の3に基づ
製造販売後調査等基本計画書に代えて、医療機器等リスク管理計画を提
く製造販売後調査等基本計画書に代えて、医療機器等リスク管理計画を、
出すること。承認後速やかに医療機器等リスク管理計画及び追加のリス
原則として当該医療機器又は体外診断用医薬品の販売開始予定時期の1
ク最小化活動として医療従事者及び患者向けに作成・提供する資材を公
か月前までに、添付資料とともに独立行政法人医薬品医療機器総合機構
表することが望ましいことから、提出は、独立行政法人医薬品医療機器総
(以下「総合機構」という。)審査業務部業務第二課に提出すること。
合機構(以下「総合機構」という。
)における確認期間を考慮して、対象
となる医療機器の承認に係る審議又は報告が行われる薬事・食品衛生審
議会医療機器・体外診断薬部会の終了後速やかに行うこと。なお、特段の
理由により、医療機器等リスク管理計画の提出に時間を要する場合であ
っても、遅くとも販売開始予定時期の1か月前までに提出すること。
(2) (略)
(2) (略)
「医療機器及び体外診断用医薬品のリスク管理計画の策定及び公表について」 新旧対照表
改
現
正 後
行
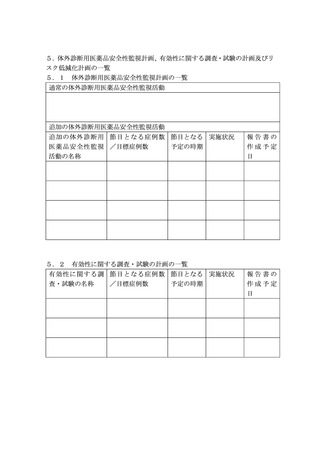
第1 医療機器等リスク管理計画の作成及び提出について
第1 医療機器等リスク管理計画の作成及び提出について
1.・2. (略)
1.
・2. (略)
3.医療機器等リスク管理計画及び製造販売後調査等実施計画書の提出に 3.医療機器等リスク管理計画及び製造販売後調査等実施計画書の提出に
ついて
ついて
(1)上記2により、承認申請時に、医療機器等リスク管理計画の案を提出 (1)上記2により、承認申請時に、医療機器等リスク管理計画の案を提出
した場合にあっては、
「新医療機器の再審査に係る製造販売後調査等基本
した場合にあっては、
「新医療機器の再審査に係る製造販売後調査等基本
計画書等について」
(平成 22 年 12 月 24 日付け薬食機発 1224 第1号厚生
計画書等について」(平成 22 年 12 月 24 日付け薬食機発 1224 第1号厚
労働省医薬食品局審査管理課医療機器審査管理室長通知)の3に基づく
生労働省医薬食品局審査管理課医療機器審査管理室長通知)の3に基づ
製造販売後調査等基本計画書に代えて、医療機器等リスク管理計画を提
く製造販売後調査等基本計画書に代えて、医療機器等リスク管理計画を、
出すること。承認後速やかに医療機器等リスク管理計画及び追加のリス
原則として当該医療機器又は体外診断用医薬品の販売開始予定時期の1
ク最小化活動として医療従事者及び患者向けに作成・提供する資材を公
か月前までに、添付資料とともに独立行政法人医薬品医療機器総合機構
表することが望ましいことから、提出は、独立行政法人医薬品医療機器総
(以下「総合機構」という。)審査業務部業務第二課に提出すること。
合機構(以下「総合機構」という。
)における確認期間を考慮して、対象
となる医療機器の承認に係る審議又は報告が行われる薬事・食品衛生審
議会医療機器・体外診断薬部会の終了後速やかに行うこと。なお、特段の
理由により、医療機器等リスク管理計画の提出に時間を要する場合であ
っても、遅くとも販売開始予定時期の1か月前までに提出すること。
(2) (略)
(2) (略)