よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
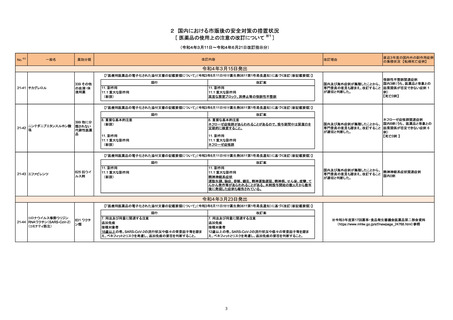
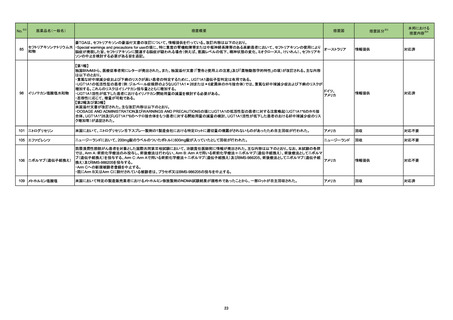
No.※2
一般名
改訂内容
薬効分類
改訂理由
直近3年度の国内外の副作用症例
の集積状況 【転帰死亡症例】
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
22-05
639 その他
インターフェロンベータ-1a(遺伝
の生物学的
子組換え)
製剤
改訂案
2. 禁忌
妊婦又は妊娠している可能性のある女性
2. 禁忌
(削除)
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物試験
(サル)において本剤の高用量の投与で流産が認められたとの報告があ
る。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性
を上回ると判断される場合にのみ投与すること。動物試験(サル)におい
て本剤の高用量の投与で流産が認められたとの報告がある。
※調査結果報告書(https://www.pmda.go.jp/files/000245831.pdf)参照
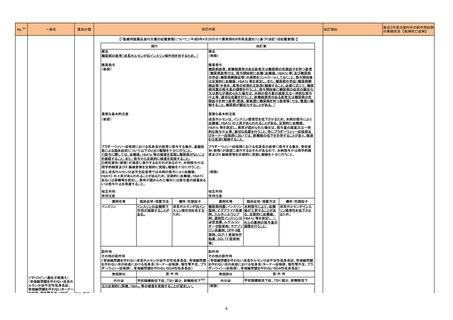
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
22-06
639 その他
インターフェロンベータ-1b(遺伝
の生物学的
子組換え)
製剤
改訂案
2. 禁忌
妊婦又は妊娠している可能性のある女性
2. 禁忌
(削除)
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物試験
(サル)において高用量の投与で胎児死亡・流産が認められたとの報告が
ある。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性
を上回ると判断される場合にのみ投与すること。動物試験(サル)におい
て高用量の投与で胎児死亡・流産が認められたとの報告がある。
※調査結果報告書(https://www.pmda.go.jp/files/000245831.pdf)参照
令和4年4月25日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
コロナウイルス修飾ウリジン
22-07 RNAワクチン(SARS-CoV-2)
(コミナティ筋注)
631 ワクチ
ン類
改訂案
7. 用法及び用量に関連する注意
追加免疫
接種時期
通常、本剤2回目の接種から少なくとも6ヵ月経過した後に3回目の接種を
行うことができる。
7. 用法及び用量に関連する注意
追加免疫
接種時期
通常、本剤2回目の接種から少なくとも5ヵ月経過した後に3回目の接種を
行うことができる。
4回目接種については、ベネフィットとリスクを考慮した上で、高齢者等に
おいて、本剤3回目の接種から少なくとも5ヶ月経過した後に接種を判断す
ることができる。
初回免疫として他のSARS-CoV-2ワクチンを接種した者に追加免疫として 他のSARS-CoV-2ワクチンを接種した者に追加免疫として本剤を接種した
本剤を接種した臨床試験は実施していない。
際の有効性、安全性は確立していない。
※令和4年度第2回薬事・食品衛生審議会医薬品第二部会資料
(https://www.mhlw.go.jp/stf/newpage_25417.html)参照
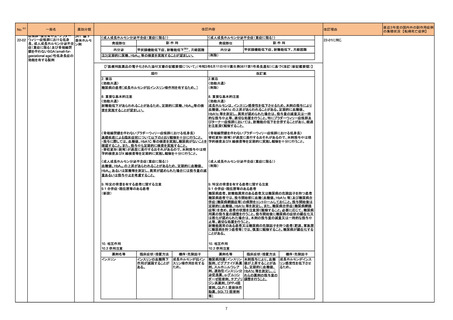
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
コロナウイルス修飾ウリジン
22-08 RNAワクチン(SARS-CoV-2)
(スパイクバックス筋注)
631 ワクチ
ン類
改訂案
7. 用法及び用量に関連する注意
追加免疫
接種時期
通常、本剤2回目の接種から少なくとも6ヵ月経過した後に3回目の接種を
行うことができる。
7. 用法及び用量に関連する注意
追加免疫
接種時期
通常、本剤2回目の接種から少なくとも5ヵ月経過した後に3回目の接種を
行うことができる。
4回目接種については、ベネフィットとリスクを考慮した上で、高齢者等に
おいて、本剤3回目の接種から少なくとも5ヵ月経過した後に接種を判断す
ることができる。
初回免疫として他のSARS-CoV-2ワクチンを接種した者に追加免疫として 他のSARS-CoV-2ワクチンを接種した者に追加免疫として本剤0.25mLを
接種した際の有効性、安全性は確立していない。
本剤0.25mLを接種した臨床試験は実施していない。
12
※令和4年度第2回薬事・食品衛生審議会医薬品第二部会資料
(https://www.mhlw.go.jp/stf/newpage_25417.html)参照
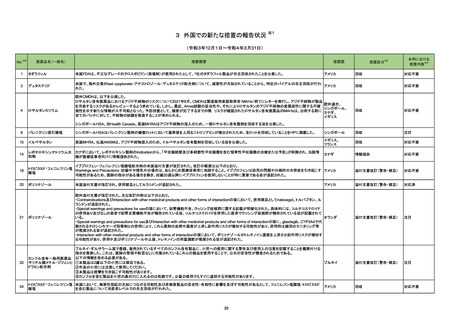
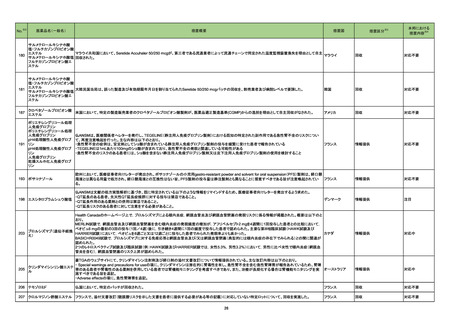
一般名
改訂内容
薬効分類
改訂理由
直近3年度の国内外の副作用症例
の集積状況 【転帰死亡症例】
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
22-05
639 その他
インターフェロンベータ-1a(遺伝
の生物学的
子組換え)
製剤
改訂案
2. 禁忌
妊婦又は妊娠している可能性のある女性
2. 禁忌
(削除)
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物試験
(サル)において本剤の高用量の投与で流産が認められたとの報告があ
る。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性
を上回ると判断される場合にのみ投与すること。動物試験(サル)におい
て本剤の高用量の投与で流産が認められたとの報告がある。
※調査結果報告書(https://www.pmda.go.jp/files/000245831.pdf)参照
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
22-06
639 その他
インターフェロンベータ-1b(遺伝
の生物学的
子組換え)
製剤
改訂案
2. 禁忌
妊婦又は妊娠している可能性のある女性
2. 禁忌
(削除)
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物試験
(サル)において高用量の投与で胎児死亡・流産が認められたとの報告が
ある。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性
を上回ると判断される場合にのみ投与すること。動物試験(サル)におい
て高用量の投与で胎児死亡・流産が認められたとの報告がある。
※調査結果報告書(https://www.pmda.go.jp/files/000245831.pdf)参照
令和4年4月25日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
コロナウイルス修飾ウリジン
22-07 RNAワクチン(SARS-CoV-2)
(コミナティ筋注)
631 ワクチ
ン類
改訂案
7. 用法及び用量に関連する注意
追加免疫
接種時期
通常、本剤2回目の接種から少なくとも6ヵ月経過した後に3回目の接種を
行うことができる。
7. 用法及び用量に関連する注意
追加免疫
接種時期
通常、本剤2回目の接種から少なくとも5ヵ月経過した後に3回目の接種を
行うことができる。
4回目接種については、ベネフィットとリスクを考慮した上で、高齢者等に
おいて、本剤3回目の接種から少なくとも5ヶ月経過した後に接種を判断す
ることができる。
初回免疫として他のSARS-CoV-2ワクチンを接種した者に追加免疫として 他のSARS-CoV-2ワクチンを接種した者に追加免疫として本剤を接種した
本剤を接種した臨床試験は実施していない。
際の有効性、安全性は確立していない。
※令和4年度第2回薬事・食品衛生審議会医薬品第二部会資料
(https://www.mhlw.go.jp/stf/newpage_25417.html)参照
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
コロナウイルス修飾ウリジン
22-08 RNAワクチン(SARS-CoV-2)
(スパイクバックス筋注)
631 ワクチ
ン類
改訂案
7. 用法及び用量に関連する注意
追加免疫
接種時期
通常、本剤2回目の接種から少なくとも6ヵ月経過した後に3回目の接種を
行うことができる。
7. 用法及び用量に関連する注意
追加免疫
接種時期
通常、本剤2回目の接種から少なくとも5ヵ月経過した後に3回目の接種を
行うことができる。
4回目接種については、ベネフィットとリスクを考慮した上で、高齢者等に
おいて、本剤3回目の接種から少なくとも5ヵ月経過した後に接種を判断す
ることができる。
初回免疫として他のSARS-CoV-2ワクチンを接種した者に追加免疫として 他のSARS-CoV-2ワクチンを接種した者に追加免疫として本剤0.25mLを
接種した際の有効性、安全性は確立していない。
本剤0.25mLを接種した臨床試験は実施していない。
12
※令和4年度第2回薬事・食品衛生審議会医薬品第二部会資料
(https://www.mhlw.go.jp/stf/newpage_25417.html)参照