よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
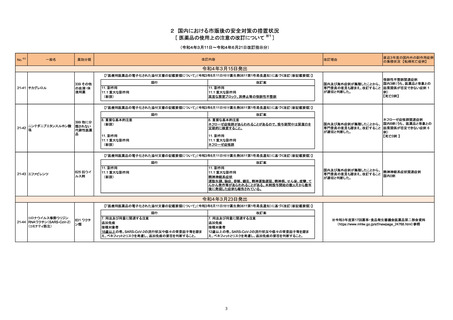
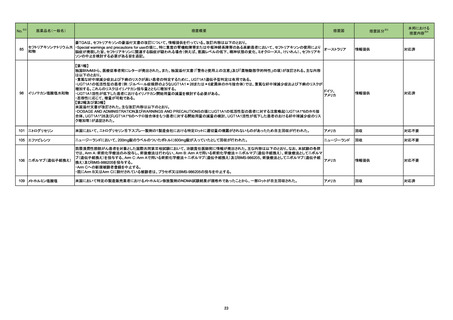
No.※2
一般名
改訂内容
薬効分類
改訂理由
直近3年度の国内外の副作用症例
の集積状況 【転帰死亡症例】
令和4年6月10日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
コロナウイルス修飾ウリジン
RNAワクチン(SARS-CoV-2)
631 ワクチ
22-16 (コミナティ筋注、コミナティ筋注
ン類
5~11歳用、スパイクバックス筋
注)
現行
8. 重要な基本的注意
(新設)
改訂案
8. 重要な基本的注意
コロナウイルス修飾ウリジンRNA ワクチン(SARS-CoV-2)接種後に、ギ
ラン・バレー症候群が報告されている。被接種者又はその保護者に対して
は、ギラン・バレー症候群が疑われる症状(四肢遠位から始まる弛緩性麻
痺、腱反射の減弱ないし消失等)が認められた場合には直ちに医師等に
相談するよう、あらかじめ説明すること。
※第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和
4年度第5回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全
対策調査会(合同開催)資料
(https://www.mhlw.go.jp/stf/shingi2/0000208910_00043.html)参照
令和4年6月14日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
8. 重要な基本的注意
(新設)
22-17
セツキシマブサロタロカンナトリ 429 その他
ウム(遺伝子組換え)
の腫瘍用薬
改訂案
8. 重要な基本的注意
レーザ光照射部位において、瘻孔、皮膚・粘膜の潰瘍又は壊死があらわ
れることがあるので、本剤投与前に皮膚又は粘膜への腫瘍浸潤の有無を
十分確認するとともに、本剤による治療中は患者の状態の観察や瘻孔、
潰瘍、壊死の有無の確認を十分に行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
皮膚又は粘膜への腫瘍浸潤が認められる患者
皮膚又は粘膜への腫瘍浸潤のある患者には、本剤の有効性及び危険性
を十分に考慮した上で、本剤による治療の可否を慎重に判断すること。
レーザ光照射部位において、瘻孔、皮膚・粘膜の潰瘍又は壊死があらわ
れることがある。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
瘻孔、皮膚・粘膜の潰瘍又は壊死
レーザ光照射部位において瘻孔、皮膚潰瘍、粘膜潰瘍、皮膚壊死、粘膜
壊死があらわれることがある。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
11.1 副作用
11.1 重大な副作用
(新設)
ニボルマブ(遺伝子組換え)
22-18 ペムブロリズマブ(遺伝子組換
え)
429 その他
の腫瘍用薬
改訂案
11.1 副作用
11.1 重大な副作用
重度の胃炎
免疫反応に起因すると考えられる重度の胃炎があらわれることがある。異
常が認められた場合には、副腎皮質ホルモン剤の投与等の適切な処置を
行うこと。
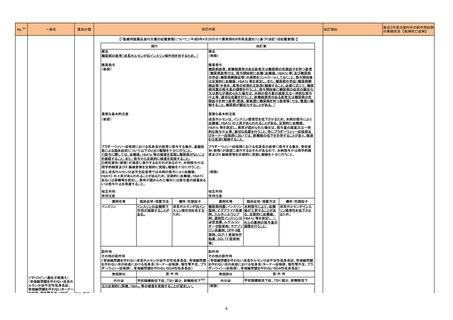
17
本剤とBioBlade レーザシステムを用い
た治療(以下、「本治療」)後に瘻孔、皮
膚潰瘍及び皮膚壊死を認めた国内及び
海外症例を評価した。専門委員の意見も
聴取した結果、本治療と瘻孔等との因果
関係の否定できない国内及び海外症例
が集積したことから、使用上の注意を改
訂することが適切と判断した。また、粘膜
にも潰瘍又は壊死が発生していることか
ら、専門委員の意見も聴取した結果、粘
膜潰瘍及び粘膜壊死についても注意喚
起を行うことが適切と判断した。
評価症例のうち、直近3 年度の瘻
孔、皮膚・粘膜潰瘍、皮膚・粘膜壊
死関連症例の集積状況は以下の
とおり。
・国内4 例(うち、医薬品と事象との
因果関係が否定できない症例4
例)【死亡0 例】
(販売開始年月:2021 年1 月)
・海外1 例(うち、医薬品と事象との
因果関係が否定できない症例1
例)【死亡0 例】
評価症例のうち、直近3年度の重
度の胃炎関連の国内症例の集積
状況は以下のとおり。
重度の胃炎関連の国内症例を評 価し ① ニボルマブ(遺伝子組換え)
た。専門委員の意見も聴取した結果、ニ ② ペムブロリズマブ(遺伝子組換
ボルマブ(遺伝子組換え)又はペムブロ え)
リズマブ(遺伝子組換え)と重度の胃炎と
の因果関係の否定できない国内症例が ①
集積したことから、使用上の注意を改訂 ・国内11 例(うち、医薬品と事象と
することが適切と判断した。また、今回認 の因果関係が否定できない症例3
められた胃炎は、免疫反応に起因すると
例)【死亡1 例(うち、医薬品と事象
考えられることから、専門委員の意見も
との因果関係が否定できない症例
聴取した結果、胃炎発生後の処置内容
についても注意喚起を行うことが適切と 0例)】
②
判断した。
・国内 12 例(うち、医薬品と事象と
の因果関係が否定できない症例3
例)【死亡0 例】
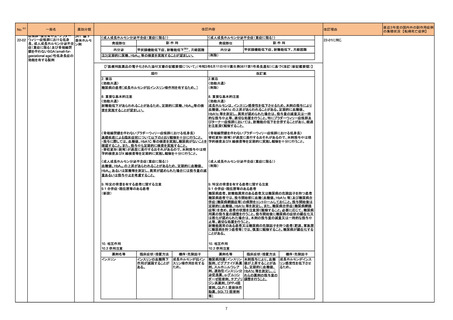
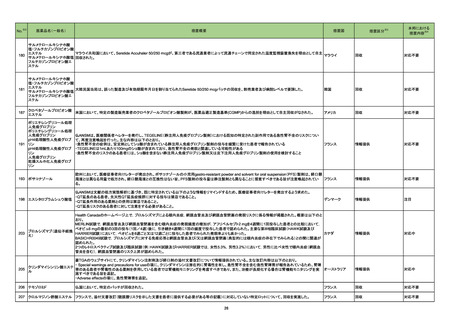
一般名
改訂内容
薬効分類
改訂理由
直近3年度の国内外の副作用症例
の集積状況 【転帰死亡症例】
令和4年6月10日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
コロナウイルス修飾ウリジン
RNAワクチン(SARS-CoV-2)
631 ワクチ
22-16 (コミナティ筋注、コミナティ筋注
ン類
5~11歳用、スパイクバックス筋
注)
現行
8. 重要な基本的注意
(新設)
改訂案
8. 重要な基本的注意
コロナウイルス修飾ウリジンRNA ワクチン(SARS-CoV-2)接種後に、ギ
ラン・バレー症候群が報告されている。被接種者又はその保護者に対して
は、ギラン・バレー症候群が疑われる症状(四肢遠位から始まる弛緩性麻
痺、腱反射の減弱ないし消失等)が認められた場合には直ちに医師等に
相談するよう、あらかじめ説明すること。
※第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和
4年度第5回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全
対策調査会(合同開催)資料
(https://www.mhlw.go.jp/stf/shingi2/0000208910_00043.html)参照
令和4年6月14日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
8. 重要な基本的注意
(新設)
22-17
セツキシマブサロタロカンナトリ 429 その他
ウム(遺伝子組換え)
の腫瘍用薬
改訂案
8. 重要な基本的注意
レーザ光照射部位において、瘻孔、皮膚・粘膜の潰瘍又は壊死があらわ
れることがあるので、本剤投与前に皮膚又は粘膜への腫瘍浸潤の有無を
十分確認するとともに、本剤による治療中は患者の状態の観察や瘻孔、
潰瘍、壊死の有無の確認を十分に行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
皮膚又は粘膜への腫瘍浸潤が認められる患者
皮膚又は粘膜への腫瘍浸潤のある患者には、本剤の有効性及び危険性
を十分に考慮した上で、本剤による治療の可否を慎重に判断すること。
レーザ光照射部位において、瘻孔、皮膚・粘膜の潰瘍又は壊死があらわ
れることがある。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
瘻孔、皮膚・粘膜の潰瘍又は壊死
レーザ光照射部位において瘻孔、皮膚潰瘍、粘膜潰瘍、皮膚壊死、粘膜
壊死があらわれることがある。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
11.1 副作用
11.1 重大な副作用
(新設)
ニボルマブ(遺伝子組換え)
22-18 ペムブロリズマブ(遺伝子組換
え)
429 その他
の腫瘍用薬
改訂案
11.1 副作用
11.1 重大な副作用
重度の胃炎
免疫反応に起因すると考えられる重度の胃炎があらわれることがある。異
常が認められた場合には、副腎皮質ホルモン剤の投与等の適切な処置を
行うこと。
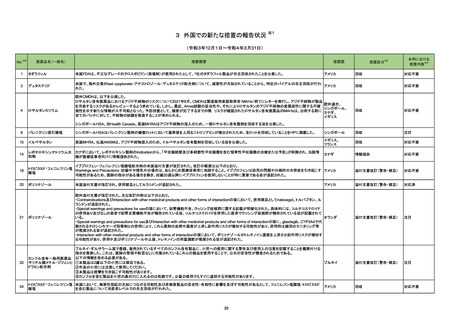
17
本剤とBioBlade レーザシステムを用い
た治療(以下、「本治療」)後に瘻孔、皮
膚潰瘍及び皮膚壊死を認めた国内及び
海外症例を評価した。専門委員の意見も
聴取した結果、本治療と瘻孔等との因果
関係の否定できない国内及び海外症例
が集積したことから、使用上の注意を改
訂することが適切と判断した。また、粘膜
にも潰瘍又は壊死が発生していることか
ら、専門委員の意見も聴取した結果、粘
膜潰瘍及び粘膜壊死についても注意喚
起を行うことが適切と判断した。
評価症例のうち、直近3 年度の瘻
孔、皮膚・粘膜潰瘍、皮膚・粘膜壊
死関連症例の集積状況は以下の
とおり。
・国内4 例(うち、医薬品と事象との
因果関係が否定できない症例4
例)【死亡0 例】
(販売開始年月:2021 年1 月)
・海外1 例(うち、医薬品と事象との
因果関係が否定できない症例1
例)【死亡0 例】
評価症例のうち、直近3年度の重
度の胃炎関連の国内症例の集積
状況は以下のとおり。
重度の胃炎関連の国内症例を評 価し ① ニボルマブ(遺伝子組換え)
た。専門委員の意見も聴取した結果、ニ ② ペムブロリズマブ(遺伝子組換
ボルマブ(遺伝子組換え)又はペムブロ え)
リズマブ(遺伝子組換え)と重度の胃炎と
の因果関係の否定できない国内症例が ①
集積したことから、使用上の注意を改訂 ・国内11 例(うち、医薬品と事象と
することが適切と判断した。また、今回認 の因果関係が否定できない症例3
められた胃炎は、免疫反応に起因すると
例)【死亡1 例(うち、医薬品と事象
考えられることから、専門委員の意見も
との因果関係が否定できない症例
聴取した結果、胃炎発生後の処置内容
についても注意喚起を行うことが適切と 0例)】
②
判断した。
・国内 12 例(うち、医薬品と事象と
の因果関係が否定できない症例3
例)【死亡0 例】