よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
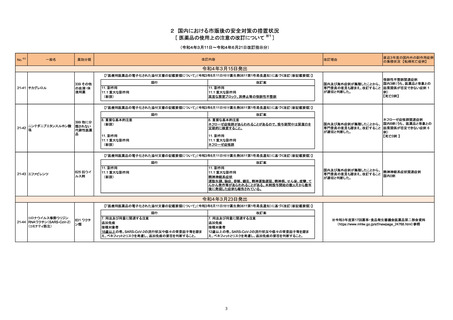
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
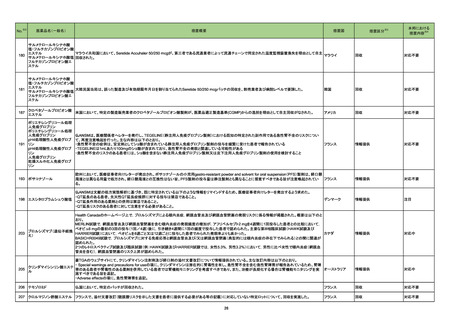
346 ヘパリンキット
製造元の調査の結果、当該製品を特定の装置にて、特定の製品と同時に測定を行う場合、キャリーオーバーが起こる可能性があることが判明したため、特定
アメリカ
の製品と同時に測定しないよう購入者に案内することとした。
情報提供
対応中
347 KRAS遺伝子変異検出キット
特定の組織に由来するサンプルの分析にのみ、まれに偽変異の結果を引き起こすリスクが確認されたため、使用者に対して情報提供及びIFUの改訂を実施
する。
情報提供
対応中
348 培養同定・一般細菌キット
海外からの顧客報告を受け海外製造元が調査した結果、精度管理株を用いて精度管理試験を実施すると、白糖ウェルで信頼性のある陰性反応が得られず、
誤ったQC結果となり、患者結果報告が遅延する可能性があることがわかった。これにより、対象の医療機関等に、本精度管理株の代わりに、別精度管理株を
アメリカ
ご使用いただくよう情報提供する。今後、対象製品の電子添付文書を改訂し、別精度管理株を用いるように変更する予定である。なお、製造元での調査は完
了し、本事象の原因は特定されなかったが、本対応策により本事象の再発は防止できると結論に至った。
情報提供
対応中
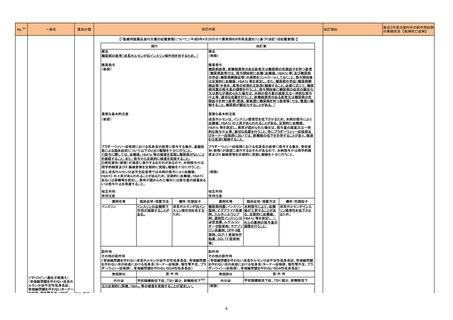
製造元の苦情調査の結果、増幅・検出試薬トレイ1内で高濃度HBVを含むウェルから隣接するウェルへのキャリーオーバーにより、検体の結果が偽高値となる
可能性があることが確認された。体外診断用医薬品である当該製品の問題はなく、当該事象はアプリケーション仕様ファイルによりコントロールされる増幅・検
出試薬トレイ1内での溶液の動きにより発生する事象である。
原因として、増幅・検出試薬トレイ1内に核酸溶出液、活性試薬を分注・攪拌する際に、気泡が形成される可能性があり、それによりオーバーフローが生じ、近
隣のウェルにキャリーオーバーが起こる可能性があることが確認された。 現行添付文書のキャリーオーバーの記載は、設計開発時に実施された検体架設およ
びDNA抽出工程で発生するキャリーオーバを想定した試験結果に基づいており、増幅・検出試薬トレイ1内でのキャリーオーバーを想定した試験は含まれてい
なかった。そのためキャリーオーバーの発生を予測した注意事項が十分に記載されていなかった。
是正措置としては、増幅・検出試薬トレイ1内の気泡形成を抑えるように、アッセイアプリケーション仕様ファイルを変更する予定である。 添付文書を変更し、最
新の試験結果に基づいてキャリーオーバーの発生率を更新し、キャリーオーバーが発生した際の注意事項を追加する。
アメリカ、
欧州連合、
イギリス、
カナダ、
オーストラリア
情報提供
対応中
韓国において製品変更に関する薬事承認を規制当局から受ける前に変更後の製品を流通させたことにより、韓国国内での自主回収を計画した。
韓国
回収
対応不要
製造元は、当該製品を用いて、HCG値が5000mIU/mL以上の未希釈検体の測定直後にHCGを測定した場合、測定結果が誤って高くなる可能性があることを
ヒト絨毛性性腺刺激ホルモン
確認した。本事象は、血清及び尿の患者検体、品質管理検体、アジャスターに影響を及ぼす。現在製造元で原因を調査中。顧客には本事象について案内し、 欧州連合
キット
HCG結果が2.5mIU/mL~750mIU/mLの間であれば、再測定するよう依頼する。
情報提供
対応中
製造元は、当該製品で血漿検体を使用した場合に、分析測定範囲全体で結果が誤って高くなることを確認した。本事象については調査継続中のため、現時点
では限られたデータしか入手できていない。このため製造元は、追って周知するまでの間、以下2点を依頼する。
欧州連合
・当該製品での検体採取及び検査に血漿検体を使用しないこと。
・血清検体の検査には当該製品を使用可能であること。
情報提供
対応中
349
B型肝炎ウイルス表面核酸
キット
ヒト脳性ナトリウム利尿ペプ
350 チド前駆体N端フラグメント
キット
351
352 エストラジオールキット
ドイツ
本邦における措置内容は、製造販売業者からの報告を受け(独)医薬品医療機器総合機構(PMDA)で状況を整理した時点のもの。
※1 本表は、令和4年6月22日の令和4年度第1回薬事・食品衛生審議会医薬品等安全対策部会に報告した内容について、「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定)に基づき抜粋したも
の。
※2 「No.」は薬事・食品衛生審議会医薬品等安全対策部会の資料中でそれぞれの報告に付与された番号。
※3 「措置区分」の語句は以下を指す。
・販売中止・不承認:安全性の懸念による販売中止又は不承認
・回収:回収情報
・情報提供:医療従事者向けの情報提供
・添付文書改訂(警告・禁忌):添付文書改訂のうち、警告、禁忌の新設がなされたもの
※4 「本邦における措置内容」の語句は以下を指す。
・対応済:添付文書の記載等があり注意喚起済みのもの
・対応不要:我が国の状況から対応する必要がないもの
・対応中:現在、安全対策措置について検討中のもの
・注目:現在得られている情報からは安全対策措置の検討に至らず、更なる情報を収集して検討するもの
33
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
346 ヘパリンキット
製造元の調査の結果、当該製品を特定の装置にて、特定の製品と同時に測定を行う場合、キャリーオーバーが起こる可能性があることが判明したため、特定
アメリカ
の製品と同時に測定しないよう購入者に案内することとした。
情報提供
対応中
347 KRAS遺伝子変異検出キット
特定の組織に由来するサンプルの分析にのみ、まれに偽変異の結果を引き起こすリスクが確認されたため、使用者に対して情報提供及びIFUの改訂を実施
する。
情報提供
対応中
348 培養同定・一般細菌キット
海外からの顧客報告を受け海外製造元が調査した結果、精度管理株を用いて精度管理試験を実施すると、白糖ウェルで信頼性のある陰性反応が得られず、
誤ったQC結果となり、患者結果報告が遅延する可能性があることがわかった。これにより、対象の医療機関等に、本精度管理株の代わりに、別精度管理株を
アメリカ
ご使用いただくよう情報提供する。今後、対象製品の電子添付文書を改訂し、別精度管理株を用いるように変更する予定である。なお、製造元での調査は完
了し、本事象の原因は特定されなかったが、本対応策により本事象の再発は防止できると結論に至った。
情報提供
対応中
製造元の苦情調査の結果、増幅・検出試薬トレイ1内で高濃度HBVを含むウェルから隣接するウェルへのキャリーオーバーにより、検体の結果が偽高値となる
可能性があることが確認された。体外診断用医薬品である当該製品の問題はなく、当該事象はアプリケーション仕様ファイルによりコントロールされる増幅・検
出試薬トレイ1内での溶液の動きにより発生する事象である。
原因として、増幅・検出試薬トレイ1内に核酸溶出液、活性試薬を分注・攪拌する際に、気泡が形成される可能性があり、それによりオーバーフローが生じ、近
隣のウェルにキャリーオーバーが起こる可能性があることが確認された。 現行添付文書のキャリーオーバーの記載は、設計開発時に実施された検体架設およ
びDNA抽出工程で発生するキャリーオーバを想定した試験結果に基づいており、増幅・検出試薬トレイ1内でのキャリーオーバーを想定した試験は含まれてい
なかった。そのためキャリーオーバーの発生を予測した注意事項が十分に記載されていなかった。
是正措置としては、増幅・検出試薬トレイ1内の気泡形成を抑えるように、アッセイアプリケーション仕様ファイルを変更する予定である。 添付文書を変更し、最
新の試験結果に基づいてキャリーオーバーの発生率を更新し、キャリーオーバーが発生した際の注意事項を追加する。
アメリカ、
欧州連合、
イギリス、
カナダ、
オーストラリア
情報提供
対応中
韓国において製品変更に関する薬事承認を規制当局から受ける前に変更後の製品を流通させたことにより、韓国国内での自主回収を計画した。
韓国
回収
対応不要
製造元は、当該製品を用いて、HCG値が5000mIU/mL以上の未希釈検体の測定直後にHCGを測定した場合、測定結果が誤って高くなる可能性があることを
ヒト絨毛性性腺刺激ホルモン
確認した。本事象は、血清及び尿の患者検体、品質管理検体、アジャスターに影響を及ぼす。現在製造元で原因を調査中。顧客には本事象について案内し、 欧州連合
キット
HCG結果が2.5mIU/mL~750mIU/mLの間であれば、再測定するよう依頼する。
情報提供
対応中
製造元は、当該製品で血漿検体を使用した場合に、分析測定範囲全体で結果が誤って高くなることを確認した。本事象については調査継続中のため、現時点
では限られたデータしか入手できていない。このため製造元は、追って周知するまでの間、以下2点を依頼する。
欧州連合
・当該製品での検体採取及び検査に血漿検体を使用しないこと。
・血清検体の検査には当該製品を使用可能であること。
情報提供
対応中
349
B型肝炎ウイルス表面核酸
キット
ヒト脳性ナトリウム利尿ペプ
350 チド前駆体N端フラグメント
キット
351
352 エストラジオールキット
ドイツ
本邦における措置内容は、製造販売業者からの報告を受け(独)医薬品医療機器総合機構(PMDA)で状況を整理した時点のもの。
※1 本表は、令和4年6月22日の令和4年度第1回薬事・食品衛生審議会医薬品等安全対策部会に報告した内容について、「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定)に基づき抜粋したも
の。
※2 「No.」は薬事・食品衛生審議会医薬品等安全対策部会の資料中でそれぞれの報告に付与された番号。
※3 「措置区分」の語句は以下を指す。
・販売中止・不承認:安全性の懸念による販売中止又は不承認
・回収:回収情報
・情報提供:医療従事者向けの情報提供
・添付文書改訂(警告・禁忌):添付文書改訂のうち、警告、禁忌の新設がなされたもの
※4 「本邦における措置内容」の語句は以下を指す。
・対応済:添付文書の記載等があり注意喚起済みのもの
・対応不要:我が国の状況から対応する必要がないもの
・対応中:現在、安全対策措置について検討中のもの
・注目:現在得られている情報からは安全対策措置の検討に至らず、更なる情報を収集して検討するもの
33