よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
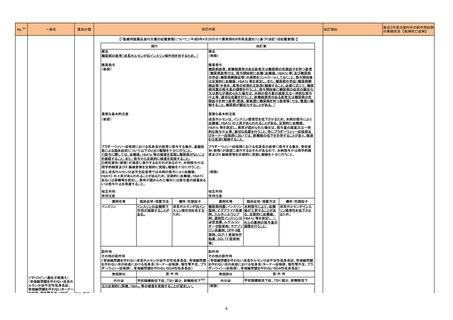
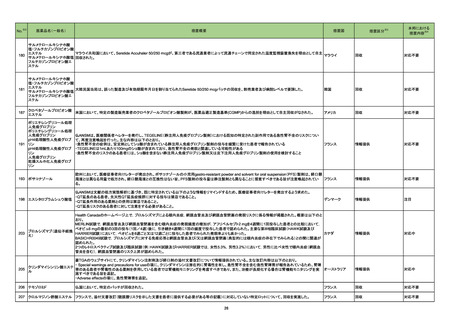
No.
85
医薬品名(一般名)
措置概要
※3
措置国
豪TGAは、セフトリアキソンの豪添付文書の改訂について、情報提供を行っている。改訂内容は以下のとおり。
セフトリアキソンナトリウム水 ・Special warnings and precautions for useの項に、特に重度の腎機能障害または中枢神経系障害のある高齢患者において、セフトリアキソンの使用により
オーストラリア
和物
脳症が発現した旨、セフトリアキソンに関連する脳症が疑われる場合(例えば、意識レベルの低下、精神状態の変化、ミオクローヌス、けいれん)、セフトリアキ
ソンの中止を検討する必要がある旨を追記。
措置区分
本邦における
措置内容※4
情報提供
対応済
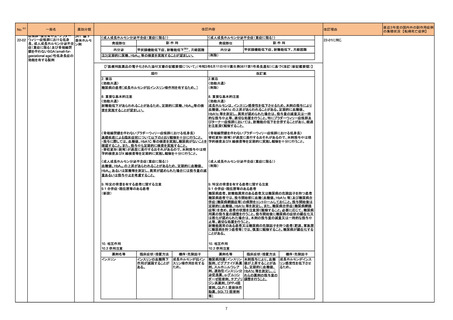
【第1報】
独国BfArMから、医療従事者宛にレターが発出された。また、独国添付文書(「警告と使用上の注意」及び「薬物動態学的特性」の項)が改訂される。主な内容
は以下のとおり。
・重篤な好中球減少症および下痢のリスクが高い患者の特定するために、UGT1A1遺伝子型判定は有用である。
・UGT1A1の低活性型の患者(例:ジルベール症候群のようなUGT1A1*28または*6変異体のホモ接合体)では、重篤な好中球減少症および下痢のリスクが
増加する。これらのリスクはイリノテカン投与量とともに増加する。
ドイツ、
・UGT1A1活性が低下した患者におけるイリノテカン開始用量の減量を検討する必要がある。
アメリカ
・忍容性に応じて、増量が可能である。
【第2報及び第3報】
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・DOSAGE AND ADMINISTRATION及びWARNINGS AND PRECAUTIONSの項にUGT1A1の低活性型の患者に対する注意喚起(UGT1A1*6のホモ接
合体、UGT1A1*28及びUGT1A1*6のヘテロ接合体をもつ患者に対する開始用量の減量の検討、UGT1A1活性が低下した患者のおける好中球減少症のリス
ク増加等)が追記された。
情報提供
対応済
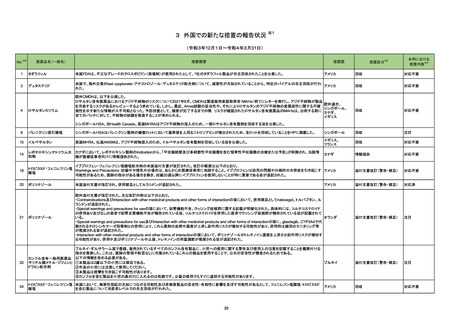
101 ニトログリセリン
米国において、ニトログリセリン舌下スプレー製剤の1製造会社における特定ロットに適切量の噴霧がされないものがあったため自主回収が行われた。
アメリカ
回収
対応不要
105 エファビレンツ
ニュージーランドにおいて、200mg錠のラベルのついたボトルに600mg錠が入っていたとして回収が行われた。
ニュージーランド
回収
対応不要
106 ニボルマブ(遺伝子組換え)
筋層浸潤性膀胱がん患者を対象とした国際共同第Ⅲ相試験において、治験責任医師宛に情報が発出された。主な内容は以下のとおり。なお、本試験の各群
では、Arm A:術前化学療法のみ投与し、術後療法は行わない、Arm B:Arm Aで用いる術前化学療法+ニボルマブ(遺伝子組換え)、術後療法としてニボルマ
ブ(遺伝子組換え)を投与する、Arm C:Arm Aで用いる術前化学療法+ニボルマブ(遺伝子組換え)及びBMS-986205、術後療法としてニボルマブ(遺伝子組
アメリカ
換え)及びBMS-986205を投与する。
・Arm Cへの新規被験者登録を中止する。
・既にArm B又はArm Cに割付されている被験者は、プラセボ又はBMS-986205の投与を中止する。
情報提供
対応不要
109 メトホルミン塩酸塩
米国において特定の製造販売業者におけるメトホルミン徐放製剤のNDMA試験結果が規格外であったことから、一部ロットが自主回収された。
回収
対応済
98
イリノテカン塩酸塩水和物
23
アメリカ
No.
85
医薬品名(一般名)
措置概要
※3
措置国
豪TGAは、セフトリアキソンの豪添付文書の改訂について、情報提供を行っている。改訂内容は以下のとおり。
セフトリアキソンナトリウム水 ・Special warnings and precautions for useの項に、特に重度の腎機能障害または中枢神経系障害のある高齢患者において、セフトリアキソンの使用により
オーストラリア
和物
脳症が発現した旨、セフトリアキソンに関連する脳症が疑われる場合(例えば、意識レベルの低下、精神状態の変化、ミオクローヌス、けいれん)、セフトリアキ
ソンの中止を検討する必要がある旨を追記。
措置区分
本邦における
措置内容※4
情報提供
対応済
【第1報】
独国BfArMから、医療従事者宛にレターが発出された。また、独国添付文書(「警告と使用上の注意」及び「薬物動態学的特性」の項)が改訂される。主な内容
は以下のとおり。
・重篤な好中球減少症および下痢のリスクが高い患者の特定するために、UGT1A1遺伝子型判定は有用である。
・UGT1A1の低活性型の患者(例:ジルベール症候群のようなUGT1A1*28または*6変異体のホモ接合体)では、重篤な好中球減少症および下痢のリスクが
増加する。これらのリスクはイリノテカン投与量とともに増加する。
ドイツ、
・UGT1A1活性が低下した患者におけるイリノテカン開始用量の減量を検討する必要がある。
アメリカ
・忍容性に応じて、増量が可能である。
【第2報及び第3報】
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・DOSAGE AND ADMINISTRATION及びWARNINGS AND PRECAUTIONSの項にUGT1A1の低活性型の患者に対する注意喚起(UGT1A1*6のホモ接
合体、UGT1A1*28及びUGT1A1*6のヘテロ接合体をもつ患者に対する開始用量の減量の検討、UGT1A1活性が低下した患者のおける好中球減少症のリス
ク増加等)が追記された。
情報提供
対応済
101 ニトログリセリン
米国において、ニトログリセリン舌下スプレー製剤の1製造会社における特定ロットに適切量の噴霧がされないものがあったため自主回収が行われた。
アメリカ
回収
対応不要
105 エファビレンツ
ニュージーランドにおいて、200mg錠のラベルのついたボトルに600mg錠が入っていたとして回収が行われた。
ニュージーランド
回収
対応不要
106 ニボルマブ(遺伝子組換え)
筋層浸潤性膀胱がん患者を対象とした国際共同第Ⅲ相試験において、治験責任医師宛に情報が発出された。主な内容は以下のとおり。なお、本試験の各群
では、Arm A:術前化学療法のみ投与し、術後療法は行わない、Arm B:Arm Aで用いる術前化学療法+ニボルマブ(遺伝子組換え)、術後療法としてニボルマ
ブ(遺伝子組換え)を投与する、Arm C:Arm Aで用いる術前化学療法+ニボルマブ(遺伝子組換え)及びBMS-986205、術後療法としてニボルマブ(遺伝子組
アメリカ
換え)及びBMS-986205を投与する。
・Arm Cへの新規被験者登録を中止する。
・既にArm B又はArm Cに割付されている被験者は、プラセボ又はBMS-986205の投与を中止する。
情報提供
対応不要
109 メトホルミン塩酸塩
米国において特定の製造販売業者におけるメトホルミン徐放製剤のNDMA試験結果が規格外であったことから、一部ロットが自主回収された。
回収
対応済
98
イリノテカン塩酸塩水和物
23
アメリカ