よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
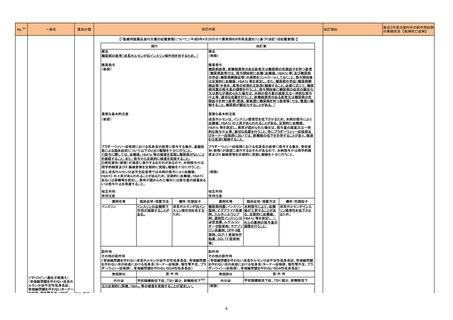
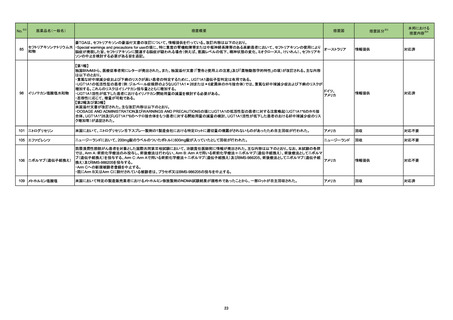
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
アジスロマイシン水和物
エリスロマイシン
クラリスロマイシン
ボノプラザンフマル酸塩・アモ
キシシリン水和物・クラリスロ
208 マイシン
エリスロマイシンステアリン酸
塩
ラベプラゾールナトリウム・ア
モキシシリン水和物・クラリス
ロマイシン
英国MHRAがヒドロキシクロロキン、クロロキンに関するDrug Safety Updateを公表し、全身性アジスロマイシン及び他のマクロライド系抗生物質(エリスロマイ
シン、クラリスロマイシン)との併用に関して注意喚起している。主な内容は以下のとおり。
・1件の観察研究は、関節リウマチ患者におけるアジスロマイシンとヒドロキシクロロキンの併用が心血管イベント(狭心症、胸痛、心不全を含む)及び心血管死
イギリス
のリスク増加と関連していることを示している。
・ヒドロキシクロロキンまたはクロロキンで治療している患者に全身性アジスロマイシン及び他のマクロロイド抗生物質(エリスロマイシン、クラリスロマイシン)を
処方する前にベネフィットとリスクを慎重に検討すること。
・併用の臨床的必要性がある場合は、心臓イベントのリスク因子を持つ患者に注意し、各薬剤の製品情報に従うこと。
情報提供
注目
217 ケタミン塩酸塩
米国FDAは,医療専門家に対して,ケタミン含有製品の鼻腔内投与についての警告をHPに掲載した。概要は以下のとおり。
2019年に精神障害に対する治療薬としてS-ケタミン製剤を承認したが,
・S-ケタミンはラセミ体のケタミンに由来するものであるが,同じ医薬品ではないこと
・FDAは,ケタミンを点鼻薬として一部の薬局が処方していることを認識しており、ケタミンの経鼻投与による精神医学的有害事象を5例把握していること
・ケタミンの点鼻薬製剤は承認していないこと
等により,妄想,解離,幻覚等の精神医学的有害事象の誘発の発現リスクを含めて,ケタミンの鼻腔内投与の安全性は確保されていない。
アメリカ
情報提供
対応不要
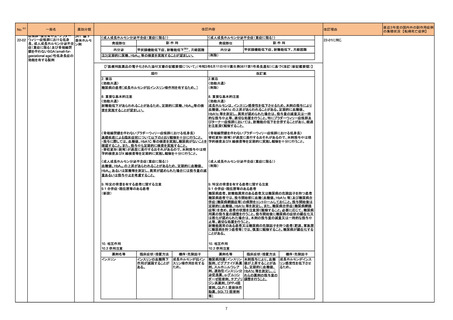
豪TGAは、海外企業のフルデオキシグルコース(18F)について、バイアルの破損があったため特定のバッチを自主回収することを公表した。
オーストラリア
回収
対応不要
Health Canadaは、Canada Vigilanceデータベース、WHOの医薬品副作用データベースおよび公表文献を検索して得られた情報をレビューし、メサドンの使
用は低血糖のリスクと関連する可能性があると結論付けた。今後、Health Canadaは、製品モノグラフにメサドンの低血糖のリスクを含めるよう製造業者へ働
きかける予定である。
カナダ
情報提供
対応中
情報提供
対応済
220
フルデオキシグルコース
(18F)
222 メサドン塩酸塩
230
実施中の本剤の臨床試験の治験責任医師宛に情報が発出された。主な内容は以下のとおり。
エンホルツマブ ベドチン(遺
・Compassionate use programにおいて死亡に至る重度皮膚副作用が報告されたことを受け、フランス及びドイツでは、Compassionate use programへの新 アメリカ
伝子組換え)
規患者の組入れが一時中断されており、イタリア、ポルトガル及びアイルランドでは、実施中の全臨床試験への新規患者の組入れが中断されている。
231 タムスロシン塩酸塩
フィリピンの添付文書が改訂された。主な改訂内容は以下のとおり。
・CONTEAINDICATIONSの項に、タムスロシンもしくはその他の成分に対する薬物誘発性血管浮腫を含む過敏症の患者へ修正された。
・UNDESIRABLE EFFECTSの項に、血管浮腫、スティーヴンス・ジョンソン症候群、光線過敏性反応が追記された。
フィリピン
添付文書改訂(警告・禁忌)
注目
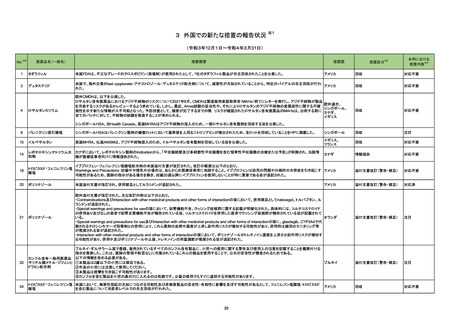
ダラツムマブ(遺伝子組換
234 え)・ボルヒアルロニダーゼ
アルファ(遺伝子組換え)
仏国において特定のバッチが回収された。
フランス
回収
対応不要
オーストラリア
情報提供
対応済
236
ルセオグリフロジン水和物
豪州TGAはSGLT2阻害剤を1型糖尿病患者へ使用した際には、糖尿病性ケトアシドーシスの発症リスクが高くなることから、当該内容を医療従事者向けに注
エンパグリフロジン
エンパグリフロジン・リナグリ 意喚起を行った。
プチン配合剤
240 イルベサルタン
欧州EMAは、イルベサルタン・ヒドロクロロチアジド配合剤の欧州添付文書に急性呼吸窮迫症候群(ARDS)に関する警告等を追加した。
欧州連合
添付文書改訂(警告・禁忌)
対応不要
241 ビガバトリン
イランにおいて、有効成分含有量が規定外であったためビガバトリン錠2ロットが回収された。
イラン
回収
対応不要
246 セルトラリン塩酸塩
サウジアラビアSFDAはセルトラリンを分娩の前の最後の月に使用した場合、分娩後出血リスクがわずかに増加することを医療専門家に通知した。
サウジアラビア
情報提供
注目
247 プロプラノロール塩酸塩
ヘルスカナダは、ニトロソアミン不純物 が許容レベルを超えて検出されたため、1社の製品が回収されることを公表した。
カナダ
回収
対応不要
27
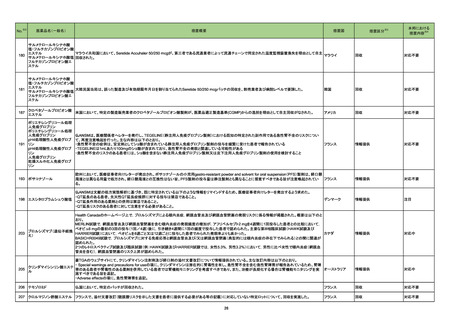
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
アジスロマイシン水和物
エリスロマイシン
クラリスロマイシン
ボノプラザンフマル酸塩・アモ
キシシリン水和物・クラリスロ
208 マイシン
エリスロマイシンステアリン酸
塩
ラベプラゾールナトリウム・ア
モキシシリン水和物・クラリス
ロマイシン
英国MHRAがヒドロキシクロロキン、クロロキンに関するDrug Safety Updateを公表し、全身性アジスロマイシン及び他のマクロライド系抗生物質(エリスロマイ
シン、クラリスロマイシン)との併用に関して注意喚起している。主な内容は以下のとおり。
・1件の観察研究は、関節リウマチ患者におけるアジスロマイシンとヒドロキシクロロキンの併用が心血管イベント(狭心症、胸痛、心不全を含む)及び心血管死
イギリス
のリスク増加と関連していることを示している。
・ヒドロキシクロロキンまたはクロロキンで治療している患者に全身性アジスロマイシン及び他のマクロロイド抗生物質(エリスロマイシン、クラリスロマイシン)を
処方する前にベネフィットとリスクを慎重に検討すること。
・併用の臨床的必要性がある場合は、心臓イベントのリスク因子を持つ患者に注意し、各薬剤の製品情報に従うこと。
情報提供
注目
217 ケタミン塩酸塩
米国FDAは,医療専門家に対して,ケタミン含有製品の鼻腔内投与についての警告をHPに掲載した。概要は以下のとおり。
2019年に精神障害に対する治療薬としてS-ケタミン製剤を承認したが,
・S-ケタミンはラセミ体のケタミンに由来するものであるが,同じ医薬品ではないこと
・FDAは,ケタミンを点鼻薬として一部の薬局が処方していることを認識しており、ケタミンの経鼻投与による精神医学的有害事象を5例把握していること
・ケタミンの点鼻薬製剤は承認していないこと
等により,妄想,解離,幻覚等の精神医学的有害事象の誘発の発現リスクを含めて,ケタミンの鼻腔内投与の安全性は確保されていない。
アメリカ
情報提供
対応不要
豪TGAは、海外企業のフルデオキシグルコース(18F)について、バイアルの破損があったため特定のバッチを自主回収することを公表した。
オーストラリア
回収
対応不要
Health Canadaは、Canada Vigilanceデータベース、WHOの医薬品副作用データベースおよび公表文献を検索して得られた情報をレビューし、メサドンの使
用は低血糖のリスクと関連する可能性があると結論付けた。今後、Health Canadaは、製品モノグラフにメサドンの低血糖のリスクを含めるよう製造業者へ働
きかける予定である。
カナダ
情報提供
対応中
情報提供
対応済
220
フルデオキシグルコース
(18F)
222 メサドン塩酸塩
230
実施中の本剤の臨床試験の治験責任医師宛に情報が発出された。主な内容は以下のとおり。
エンホルツマブ ベドチン(遺
・Compassionate use programにおいて死亡に至る重度皮膚副作用が報告されたことを受け、フランス及びドイツでは、Compassionate use programへの新 アメリカ
伝子組換え)
規患者の組入れが一時中断されており、イタリア、ポルトガル及びアイルランドでは、実施中の全臨床試験への新規患者の組入れが中断されている。
231 タムスロシン塩酸塩
フィリピンの添付文書が改訂された。主な改訂内容は以下のとおり。
・CONTEAINDICATIONSの項に、タムスロシンもしくはその他の成分に対する薬物誘発性血管浮腫を含む過敏症の患者へ修正された。
・UNDESIRABLE EFFECTSの項に、血管浮腫、スティーヴンス・ジョンソン症候群、光線過敏性反応が追記された。
フィリピン
添付文書改訂(警告・禁忌)
注目
ダラツムマブ(遺伝子組換
234 え)・ボルヒアルロニダーゼ
アルファ(遺伝子組換え)
仏国において特定のバッチが回収された。
フランス
回収
対応不要
オーストラリア
情報提供
対応済
236
ルセオグリフロジン水和物
豪州TGAはSGLT2阻害剤を1型糖尿病患者へ使用した際には、糖尿病性ケトアシドーシスの発症リスクが高くなることから、当該内容を医療従事者向けに注
エンパグリフロジン
エンパグリフロジン・リナグリ 意喚起を行った。
プチン配合剤
240 イルベサルタン
欧州EMAは、イルベサルタン・ヒドロクロロチアジド配合剤の欧州添付文書に急性呼吸窮迫症候群(ARDS)に関する警告等を追加した。
欧州連合
添付文書改訂(警告・禁忌)
対応不要
241 ビガバトリン
イランにおいて、有効成分含有量が規定外であったためビガバトリン錠2ロットが回収された。
イラン
回収
対応不要
246 セルトラリン塩酸塩
サウジアラビアSFDAはセルトラリンを分娩の前の最後の月に使用した場合、分娩後出血リスクがわずかに増加することを医療専門家に通知した。
サウジアラビア
情報提供
注目
247 プロプラノロール塩酸塩
ヘルスカナダは、ニトロソアミン不純物 が許容レベルを超えて検出されたため、1社の製品が回収されることを公表した。
カナダ
回収
対応不要
27