よむ、つかう、まなぶ。
【参考資料5】小児がん及び小児希少難治性疾患に係る医薬品開発の推進制度に資する調査研究 令和4年度 総括・分担研究年度終了報告書 (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
✓
✓
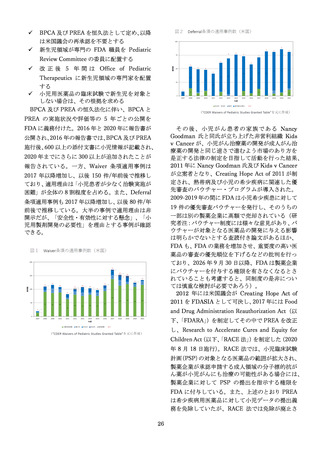
BPCA 及び PREA を恒久法として定め、以降
は米国議会の再承認を不要とする
新生児領域が専門の FDA 職員を Pediatric
Review Committee の委員に配置する
✓
改 正 後 5 年 間 は Office of Pediatric
Therapeutics に新生児領域の専門家を配置
する
✓ 小児用医薬品の臨床試験で新生児を対象と
しない場合は、その根拠を求める
BPCA 及び PREA の恒久法化に伴い、BPCA と
PREA の実施状況や評価等の 5 年ごとの公開を
そ の 後 、 小 児 が ん 患 者 の 家 族 で あ る Nancy
Goodman 氏と同氏が立ち上げた非営利組織 Kids
v Cancer が、小児がん治療薬の開発が成人がん治
療薬の開発と同じ速さで進むよう市場のあり方を
是正する法律の制定を目指して活動を行った結果、
2011 年に Nancy Goodman 氏及び Kids v Cancer
が立案者となり、Creating Hope Act of 2011 が制
定され、熱帯病及び小児の希少疾病に関連した優
先審査のバウチャー・プログラムが導入された。
2009-2019 年の間に FDA は小児希少疾患に対して
FDA に義務付けた。2016 年と 2020 年に報告書が
公開され、2016 年の報告書では、BPCA 及び PREA
施行後、600 以上の添付文書に小児情報が記載され、
2020 年までにさらに 300 以上が追加されたことが
報告されている。一方、Waiver 条項適用事例は
2017 年以降増加し、以後 150 件/年前後で推移し
ており、適用理由は「小児患者が少なく治験実施が
困難」が全体の 8 割程度を占める。また、Deferral
条項適用事例も 2017 年以降増加し、以後 80 件/年
前後で推移している。大半の事例で適用理由は非
開示だが、「安全性・有効性に対する懸念」、「小
児用製剤開発の必要性」を理由とする事例が確認
できる。
19 件の優先審査バウチャーを発行し、そのうちの
一部は別の製薬企業に高額で売却されている(研
究者注:バウチャー制度には様々な意見があり、バ
ウチャーが対象となる医薬品の開発に与える影響
は明らかでないとする査読付き論文があるほか、
FDA も、FDA の業務を増加させ、重要度の高い医
薬品の審査の優先順位を下げるなどの批判を行っ
ており、2026 年 9 月 30 日以降、FDA は製薬企業
にバウチャーを付与する権限を有さなくなるとさ
れていることも考慮すると、同制度の是非につい
ては慎重な検討が必要であろう)。
2012 年には米国議会が Creating Hope Act of
2011 を FDASIA として可決し、2017 年には Food
and Drug Administration Reauthorization Act(以
下、
「FDARA」)を制定してその中で PREA を改正
し、Research to Accelerate Cures and Equity for
Children Act(以下、
「RACE 法」
)を制定した(2020
年 8 月 18 日施行)
。RACE 法では、小児臨床試験
計画(PSP)の対象となる医薬品の範囲が拡大され、
製薬企業が承認申請する成人領域の分子標的抗が
ん薬が小児がんにも治療の可能性がある場合には、
製薬企業に対して PSP の提出を指示する権限を
FDA に付与している。また、上述のとおり PREA
は希少疾病用医薬品に対して小児データの提出義
務を免除していたが、RACE 法では免除が廃止さ
26
✓
BPCA 及び PREA を恒久法として定め、以降
は米国議会の再承認を不要とする
新生児領域が専門の FDA 職員を Pediatric
Review Committee の委員に配置する
✓
改 正 後 5 年 間 は Office of Pediatric
Therapeutics に新生児領域の専門家を配置
する
✓ 小児用医薬品の臨床試験で新生児を対象と
しない場合は、その根拠を求める
BPCA 及び PREA の恒久法化に伴い、BPCA と
PREA の実施状況や評価等の 5 年ごとの公開を
そ の 後 、 小 児 が ん 患 者 の 家 族 で あ る Nancy
Goodman 氏と同氏が立ち上げた非営利組織 Kids
v Cancer が、小児がん治療薬の開発が成人がん治
療薬の開発と同じ速さで進むよう市場のあり方を
是正する法律の制定を目指して活動を行った結果、
2011 年に Nancy Goodman 氏及び Kids v Cancer
が立案者となり、Creating Hope Act of 2011 が制
定され、熱帯病及び小児の希少疾病に関連した優
先審査のバウチャー・プログラムが導入された。
2009-2019 年の間に FDA は小児希少疾患に対して
FDA に義務付けた。2016 年と 2020 年に報告書が
公開され、2016 年の報告書では、BPCA 及び PREA
施行後、600 以上の添付文書に小児情報が記載され、
2020 年までにさらに 300 以上が追加されたことが
報告されている。一方、Waiver 条項適用事例は
2017 年以降増加し、以後 150 件/年前後で推移し
ており、適用理由は「小児患者が少なく治験実施が
困難」が全体の 8 割程度を占める。また、Deferral
条項適用事例も 2017 年以降増加し、以後 80 件/年
前後で推移している。大半の事例で適用理由は非
開示だが、「安全性・有効性に対する懸念」、「小
児用製剤開発の必要性」を理由とする事例が確認
できる。
19 件の優先審査バウチャーを発行し、そのうちの
一部は別の製薬企業に高額で売却されている(研
究者注:バウチャー制度には様々な意見があり、バ
ウチャーが対象となる医薬品の開発に与える影響
は明らかでないとする査読付き論文があるほか、
FDA も、FDA の業務を増加させ、重要度の高い医
薬品の審査の優先順位を下げるなどの批判を行っ
ており、2026 年 9 月 30 日以降、FDA は製薬企業
にバウチャーを付与する権限を有さなくなるとさ
れていることも考慮すると、同制度の是非につい
ては慎重な検討が必要であろう)。
2012 年には米国議会が Creating Hope Act of
2011 を FDASIA として可決し、2017 年には Food
and Drug Administration Reauthorization Act(以
下、
「FDARA」)を制定してその中で PREA を改正
し、Research to Accelerate Cures and Equity for
Children Act(以下、
「RACE 法」
)を制定した(2020
年 8 月 18 日施行)
。RACE 法では、小児臨床試験
計画(PSP)の対象となる医薬品の範囲が拡大され、
製薬企業が承認申請する成人領域の分子標的抗が
ん薬が小児がんにも治療の可能性がある場合には、
製薬企業に対して PSP の提出を指示する権限を
FDA に付与している。また、上述のとおり PREA
は希少疾病用医薬品に対して小児データの提出義
務を免除していたが、RACE 法では免除が廃止さ
26