よむ、つかう、まなぶ。
【参考資料5】小児がん及び小児希少難治性疾患に係る医薬品開発の推進制度に資する調査研究 令和4年度 総括・分担研究年度終了報告書 (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
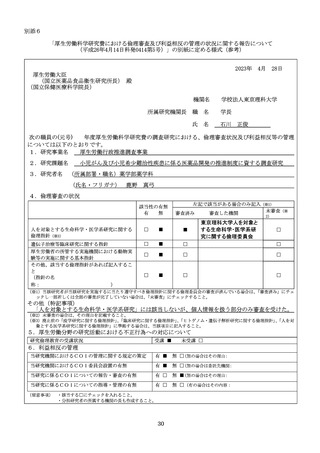
別添6
「厚生労働科学研究費における倫理審査及び利益相反の管理の状況に関する報告について
(平成26年4月14日科発0414第5号)」の別紙に定める様式(参考)
2023年 4月 28日
厚生労働大臣
(国立医薬品食品衛生研究所長) 殿
(国立保健医療科学院長)
機関名
所属研究機関長 職 名
氏 名
学校法人東京理科大学
学長
石川 正俊
次の職員の(元号)
年度厚生労働科学研究費の調査研究における、倫理審査状況及び利益相反等の管理
については以下のとおりです。
1.研究事業名
厚生労働行政推進調査事業
2.研究課題名
小児がん及び小児希少難治性疾患に係る医薬品開発の推進制度に資する調査研究
3.研究者名 (所属部署・職名)薬学部薬学科
(氏名・フリガナ)
鹿野 真弓
4.倫理審査の状況
該当性の有無
有
無
左記で該当がある場合のみ記入(※1)
未審査(※
審査済み
審査した機関
2)
東京理科大学人を対象と
する生命科学・医学系研
究に関する倫理委員会
人を対象とする生命科学・医学系研究に関する
倫理指針(※3)
□
■
■
遺伝子治療等臨床研究に関する指針
□
■
□
□
□
■
□
□
□
■
□
□
厚生労働省の所管する実施機関における動物実
験等の実施に関する基本指針
その他、該当する倫理指針があれば記入するこ
と
(指針の名
称:
)
□
(※1)当該研究者が当該研究を実施するに当たり遵守すべき倫理指針に関する倫理委員会の審査が済んでいる場合は、「審査済み」にチェ
ックし一部若しくは全部の審査が完了していない場合は、「未審査」にチェックすること。
その他(特記事項)
「人を対象とする生命科学・医学系研究」には該当しないが、個人情報を扱う部分のみ審査を受けた。
(※2)未審査の場合は、その理由を記載すること。
(※3)廃止前の「疫学研究に関する倫理指針」
、
「臨床研究に関する倫理指針」
、
「ヒトゲノム・遺伝子解析研究に関する倫理指針」、
「人を対
象とする医学系研究に関する倫理指針」に準拠する場合は、当該項目に記入すること。
5.厚生労働分野の研究活動における不正行為への対応について
研究倫理教育の受講状況
受講 ■
未受講 □
6.利益相反の管理
当研究機関におけるCOIの管理に関する規定の策定
有 ■
無 □(無の場合はその理由:
)
当研究機関におけるCOI委員会設置の有無
有 ■
無 □(無の場合は委託先機関:
)
当研究に係るCOIについての報告・審査の有無
有 □
無 ■(無の場合はその理由:
)
当研究に係るCOIについての指導・管理の有無
有 □
無 □(有の場合はその内容:
)
(留意事項) ・該当する□にチェックを入れること。
・分担研究者の所属する機関の長も作成すること。
30
「厚生労働科学研究費における倫理審査及び利益相反の管理の状況に関する報告について
(平成26年4月14日科発0414第5号)」の別紙に定める様式(参考)
2023年 4月 28日
厚生労働大臣
(国立医薬品食品衛生研究所長) 殿
(国立保健医療科学院長)
機関名
所属研究機関長 職 名
氏 名
学校法人東京理科大学
学長
石川 正俊
次の職員の(元号)
年度厚生労働科学研究費の調査研究における、倫理審査状況及び利益相反等の管理
については以下のとおりです。
1.研究事業名
厚生労働行政推進調査事業
2.研究課題名
小児がん及び小児希少難治性疾患に係る医薬品開発の推進制度に資する調査研究
3.研究者名 (所属部署・職名)薬学部薬学科
(氏名・フリガナ)
鹿野 真弓
4.倫理審査の状況
該当性の有無
有
無
左記で該当がある場合のみ記入(※1)
未審査(※
審査済み
審査した機関
2)
東京理科大学人を対象と
する生命科学・医学系研
究に関する倫理委員会
人を対象とする生命科学・医学系研究に関する
倫理指針(※3)
□
■
■
遺伝子治療等臨床研究に関する指針
□
■
□
□
□
■
□
□
□
■
□
□
厚生労働省の所管する実施機関における動物実
験等の実施に関する基本指針
その他、該当する倫理指針があれば記入するこ
と
(指針の名
称:
)
□
(※1)当該研究者が当該研究を実施するに当たり遵守すべき倫理指針に関する倫理委員会の審査が済んでいる場合は、「審査済み」にチェ
ックし一部若しくは全部の審査が完了していない場合は、「未審査」にチェックすること。
その他(特記事項)
「人を対象とする生命科学・医学系研究」には該当しないが、個人情報を扱う部分のみ審査を受けた。
(※2)未審査の場合は、その理由を記載すること。
(※3)廃止前の「疫学研究に関する倫理指針」
、
「臨床研究に関する倫理指針」
、
「ヒトゲノム・遺伝子解析研究に関する倫理指針」、
「人を対
象とする医学系研究に関する倫理指針」に準拠する場合は、当該項目に記入すること。
5.厚生労働分野の研究活動における不正行為への対応について
研究倫理教育の受講状況
受講 ■
未受講 □
6.利益相反の管理
当研究機関におけるCOIの管理に関する規定の策定
有 ■
無 □(無の場合はその理由:
)
当研究機関におけるCOI委員会設置の有無
有 ■
無 □(無の場合は委託先機関:
)
当研究に係るCOIについての報告・審査の有無
有 □
無 ■(無の場合はその理由:
)
当研究に係るCOIについての指導・管理の有無
有 □
無 □(有の場合はその内容:
)
(留意事項) ・該当する□にチェックを入れること。
・分担研究者の所属する機関の長も作成すること。
30