よむ、つかう、まなぶ。
薬-1○関係業界からの意見聴取について (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00073.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第209回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
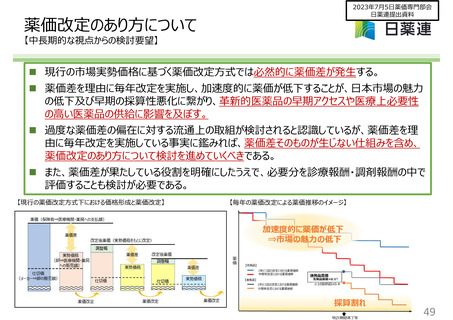
【参考】既収載品の個別銘柄の対象品目、企業要件
対象品目
①、②のいずれかに該当する品目
①医療上の必要性の高い医薬品
②収載10年未満かつ、GE内シェア率50%以上の品目
(徐々に対象品目の拡大を図る)
企業要件
• 製造管理や品質管理に関する情報(例えば製造所、原薬
の複数ソース化等)を開示している。
•品目毎に「平時の供給量と最大可能製造量」を届け出る。
(なお、承認予定社数に応じて下限数量を設定)
※現在進められている後発品産業のあり方に関する検討
会の議論も踏まえ、検討していく必要があると考えます。
Copyright © 2023 Japan Generic Medicines Association All Rights Reserved.
18
対象品目
①、②のいずれかに該当する品目
①医療上の必要性の高い医薬品
②収載10年未満かつ、GE内シェア率50%以上の品目
(徐々に対象品目の拡大を図る)
企業要件
• 製造管理や品質管理に関する情報(例えば製造所、原薬
の複数ソース化等)を開示している。
•品目毎に「平時の供給量と最大可能製造量」を届け出る。
(なお、承認予定社数に応じて下限数量を設定)
※現在進められている後発品産業のあり方に関する検討
会の議論も踏まえ、検討していく必要があると考えます。
Copyright © 2023 Japan Generic Medicines Association All Rights Reserved.
18