よむ、つかう、まなぶ。
薬-1○関係業界からの意見聴取について (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00073.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第209回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
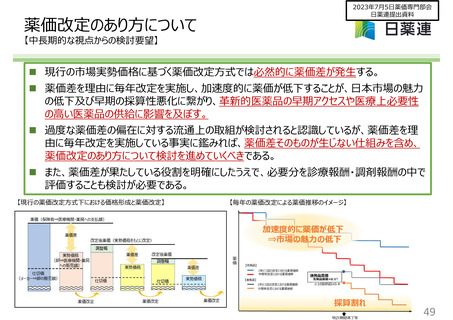
薬価算定組織の意見に対する見解①
イノベーションの評価
新薬創出等加算における品目要件の合理化
新薬創出等加算の品目要件における、「有用性加算等に該当した薬理作用類似薬1番手から3年、3番手以内に
収載された品目」については、当該品目は1番手と同時期に開発が開始され、有用性と革新性の程度のみならず、
開発リスクも同程度であると考えられることから設定されたものと認識している。
今般の提案については、上記のようなルールの趣旨も踏まえつつ慎重に検討されるべきと考える。
改定時加算の取扱い
追加された効能ごとに加算の該当性を判断し、併算定を認めることや、新薬創出等加算又は再算定適用時におけ
る薬価改定時の加算の適用方法を見直すことには賛同する。
標準的治療法の定義
薬価収載前には国内に使用実態がないながらも、臨床試験の結果から薬価収載後には本邦で標準的治療法とな
ることが明らかであると見込まれる場合等は、有用性加算の評価の対象として取り扱うことに賛同する。
27
イノベーションの評価
新薬創出等加算における品目要件の合理化
新薬創出等加算の品目要件における、「有用性加算等に該当した薬理作用類似薬1番手から3年、3番手以内に
収載された品目」については、当該品目は1番手と同時期に開発が開始され、有用性と革新性の程度のみならず、
開発リスクも同程度であると考えられることから設定されたものと認識している。
今般の提案については、上記のようなルールの趣旨も踏まえつつ慎重に検討されるべきと考える。
改定時加算の取扱い
追加された効能ごとに加算の該当性を判断し、併算定を認めることや、新薬創出等加算又は再算定適用時におけ
る薬価改定時の加算の適用方法を見直すことには賛同する。
標準的治療法の定義
薬価収載前には国内に使用実態がないながらも、臨床試験の結果から薬価収載後には本邦で標準的治療法とな
ることが明らかであると見込まれる場合等は、有用性加算の評価の対象として取り扱うことに賛同する。
27