よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
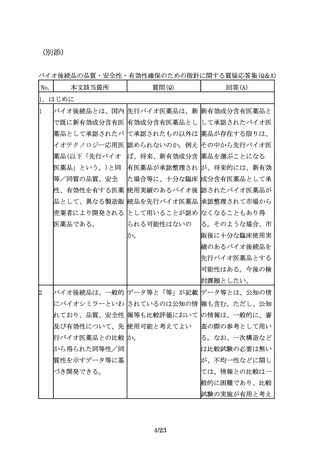
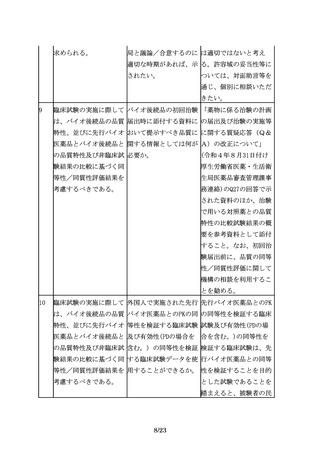
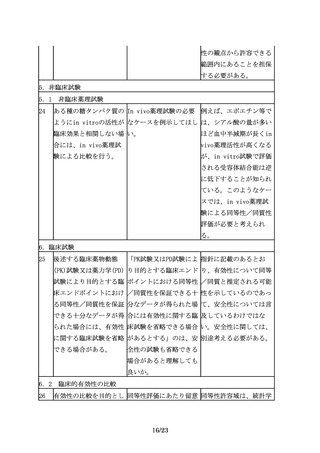
の品質特性及び非臨床試 ばよいのか。
の臨床試験のサブグルー
験結果の比較に基づく同
プ解析により確認するこ
等性/同質性評価結果を
とが考えられる。また、
考慮するべきである。
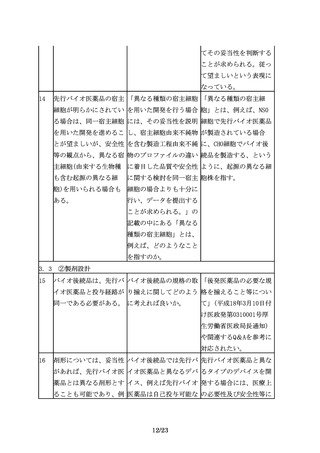
バイオ後続品と先行バイ
オ医薬品の品質特性に差
が認められた場合には、
当該差異に着目して、民
族的要因及びその影響を
評価することが重要であ
る。
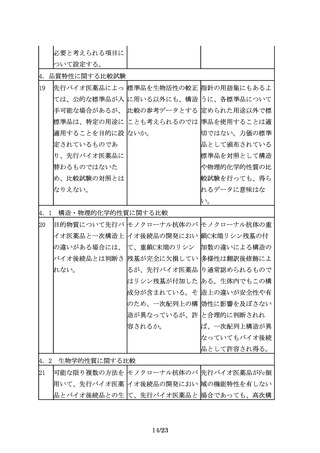
3.2 先行バイオ医薬品
12
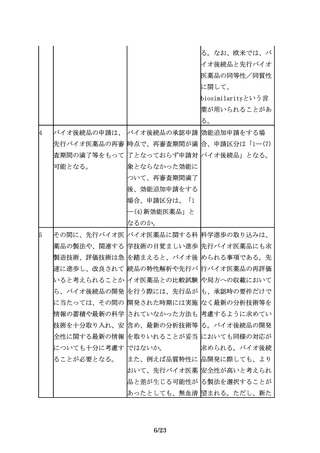
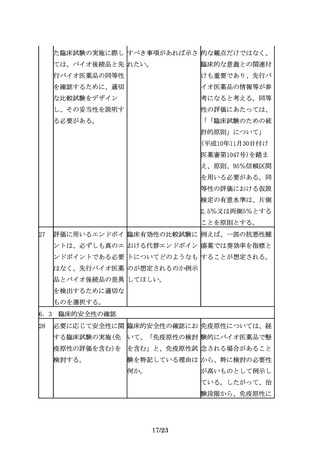
海外で承認されている製 「同一の製品」の定義と 一般的名称が同一でも販
品(以下「海外承認品」 は、何を指すのか。
売名が異なる承認品もあ
という。)を対照薬とし 例えば、バイオ後続品開 る。
て用いた試験成績を、本 発期間中に先行バイオ医 すなわちここでいう同一
邦でのバイオ後続品の承 薬品の製法、処方等に変 の製品とは同一の承認を
認申請に利用する場合に 更があった場合でも原則 得ている製品を指す。た
は、国内承認品と海外承 として同一の一般名称で だし、同一製品を複数の
認品が同一とみなせるこ あれば「同一の製品」と 社が別の販売名で市販し
とを、両者の品質比較試 みなしてもよいか。
ていることもあるが、こ
験結果等に基づき説明す
の場合にはどちらの製品
る必要がある。
を用いてもよい可能性が
ある。
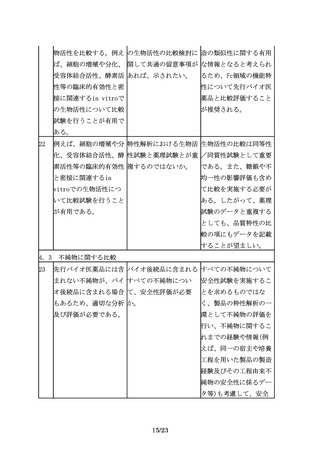
国内承認品と海外承認品
の同一性については、各
製品の製造所情報等に関
する公開情報が参考にな
る場合もあるので、情報
を収集しておくことが望
ましい。
バイオ後続品と先行バイ
10/23
の臨床試験のサブグルー
験結果の比較に基づく同
プ解析により確認するこ
等性/同質性評価結果を
とが考えられる。また、
考慮するべきである。
バイオ後続品と先行バイ
オ医薬品の品質特性に差
が認められた場合には、
当該差異に着目して、民
族的要因及びその影響を
評価することが重要であ
る。
3.2 先行バイオ医薬品
12
海外で承認されている製 「同一の製品」の定義と 一般的名称が同一でも販
品(以下「海外承認品」 は、何を指すのか。
売名が異なる承認品もあ
という。)を対照薬とし 例えば、バイオ後続品開 る。
て用いた試験成績を、本 発期間中に先行バイオ医 すなわちここでいう同一
邦でのバイオ後続品の承 薬品の製法、処方等に変 の製品とは同一の承認を
認申請に利用する場合に 更があった場合でも原則 得ている製品を指す。た
は、国内承認品と海外承 として同一の一般名称で だし、同一製品を複数の
認品が同一とみなせるこ あれば「同一の製品」と 社が別の販売名で市販し
とを、両者の品質比較試 みなしてもよいか。
ていることもあるが、こ
験結果等に基づき説明す
の場合にはどちらの製品
る必要がある。
を用いてもよい可能性が
ある。
国内承認品と海外承認品
の同一性については、各
製品の製造所情報等に関
する公開情報が参考にな
る場合もあるので、情報
を収集しておくことが望
ましい。
バイオ後続品と先行バイ
10/23