よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
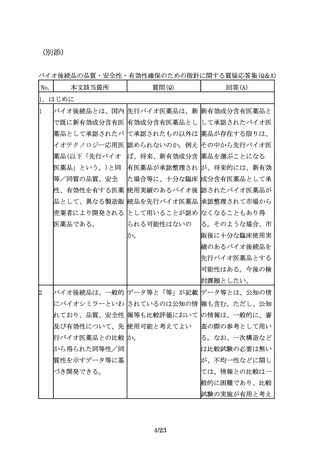
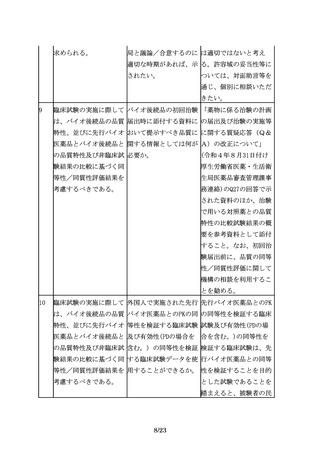
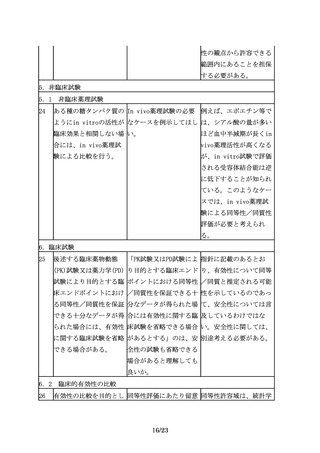
バイオ医薬品が複数の効 査期間が満了していない オ後続品と先行バイオ医
能・効果を有する場合、 効能・効果及び用法・用 薬品の同等性検証に適し
臨床試験を実施していな 量で有効性の同等性を検 た効能・効果及び用法・
い効能・効果において
証した場合、当該臨床試 用量を対象としたもので
も、薬理学的に先行バイ 験成績を以て、再審査期 あって、それにより、承
オ医薬品と同様の作用が 間が満了している効能・ 認申請を行う効能・効果
期待でき、安全性プロフ 効果、用法・用量を対象 及び用法・用量における
ァイルにも問題がないこ とした承認申請を行うこ バイオ後続品と先行バイ
とが説明できるのであれ とは可能か。
オ医薬品の有効性が同等
ば、それぞれの効能・効
で安全性プロファイルが
果での用法・用量や投与
同様であると推察される
期間の異同に関わらず、
ことを説明できる場合に
それらの効能・効果をバ
は、当該臨床試験成績を
イオ後続品に付与するこ
以て、承認申請を行うこ
とが可能となる(外挿)。
とは可能である。ただ
し、初回承認時に、同等
性の検証的試験が実施さ
れた効能・効果及び用
法・用量を取得すること
はできないため、先行バ
イオ医薬品の再審査期間
満了に伴い、改めて一部
変更承認申請を行う必要
があることに留意するこ
と。
34
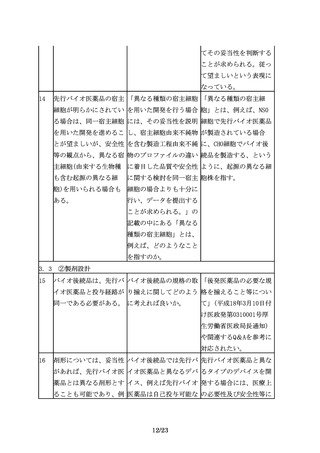
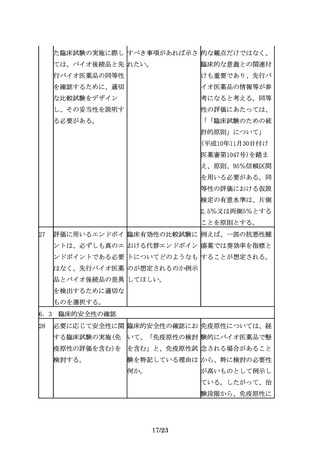
臨床試験を実施していな 先行バイオ医薬品で承認 先行バイオ医薬品に含ま
い効能・効果の付与が可 されていないが他の既承 れない効能について、別
能となるのは、対照薬と 認バイオ医薬品で承認さ 途臨床試験を実施すれば
して用いた先行バイオ医 れている効能・効果ある 追加の申請を行うことは
薬品のもつ効能・効果に いは、新規の効能・効果 可能であると考える。
限られ、先行バイオ医薬 について、新たに臨床試
21/23
能・効果を有する場合、 効能・効果及び用法・用 薬品の同等性検証に適し
臨床試験を実施していな 量で有効性の同等性を検 た効能・効果及び用法・
い効能・効果において
証した場合、当該臨床試 用量を対象としたもので
も、薬理学的に先行バイ 験成績を以て、再審査期 あって、それにより、承
オ医薬品と同様の作用が 間が満了している効能・ 認申請を行う効能・効果
期待でき、安全性プロフ 効果、用法・用量を対象 及び用法・用量における
ァイルにも問題がないこ とした承認申請を行うこ バイオ後続品と先行バイ
とが説明できるのであれ とは可能か。
オ医薬品の有効性が同等
ば、それぞれの効能・効
で安全性プロファイルが
果での用法・用量や投与
同様であると推察される
期間の異同に関わらず、
ことを説明できる場合に
それらの効能・効果をバ
は、当該臨床試験成績を
イオ後続品に付与するこ
以て、承認申請を行うこ
とが可能となる(外挿)。
とは可能である。ただ
し、初回承認時に、同等
性の検証的試験が実施さ
れた効能・効果及び用
法・用量を取得すること
はできないため、先行バ
イオ医薬品の再審査期間
満了に伴い、改めて一部
変更承認申請を行う必要
があることに留意するこ
と。
34
臨床試験を実施していな 先行バイオ医薬品で承認 先行バイオ医薬品に含ま
い効能・効果の付与が可 されていないが他の既承 れない効能について、別
能となるのは、対照薬と 認バイオ医薬品で承認さ 途臨床試験を実施すれば
して用いた先行バイオ医 れている効能・効果ある 追加の申請を行うことは
薬品のもつ効能・効果に いは、新規の効能・効果 可能であると考える。
限られ、先行バイオ医薬 について、新たに臨床試
21/23