よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
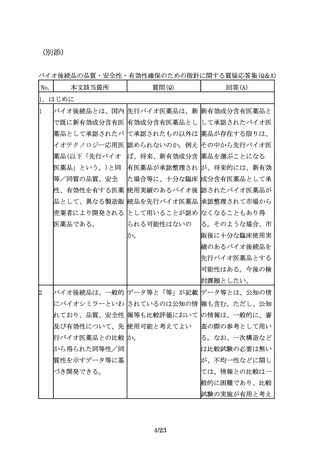
性の観点から許容できる
範囲内にあることを担保
する必要がある。
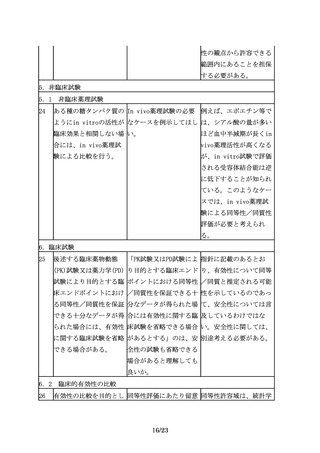
5.非臨床試験
5.1 非臨床薬理試験
24
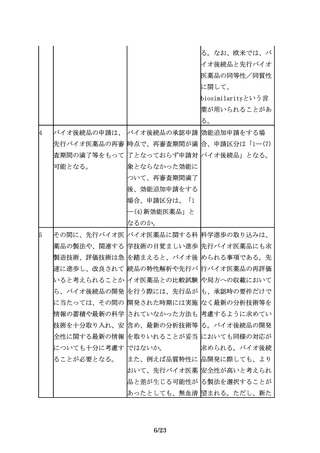
ある種の糖タンパク質の In vivo薬理試験の必要 例えば、エポエチン等で
ようにin vitroの活性が なケースを例示してほし は、シアル酸の量が多い
臨床効果と相関しない場 い。
ほど血中半減期が長くin
合には、in vivo薬理試
vivo薬理活性が高くなる
験による比較を行う。
が、in vitro試験で評価
される受容体結合能は逆
に低下することが知られ
ている。このようなケー
スでは、in vivo薬理試
験による同等性/同質性
評価が必要と考えられ
る。
6.臨床試験
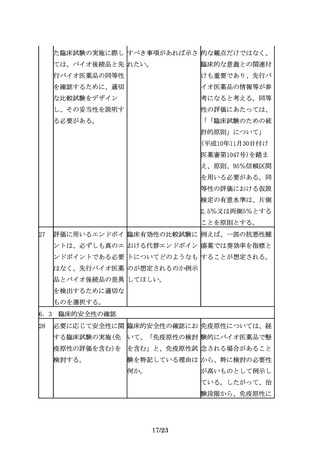
25
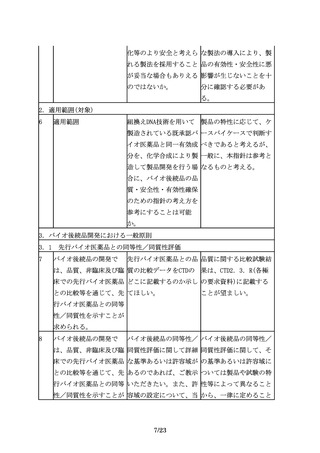
後述する臨床薬物動態
「PK試験又はPD試験によ 指針に記載のあるとお
(PK)試験又は薬力学(PD) り目的とする臨床エンド り、有効性について同等
試験により目的とする臨 ポイントにおける同等性 /同質と推定される可能
床エンドポイントにおけ /同質性を保証できる十 性を示しているのであっ
る同等性/同質性を保証 分なデータが得られた場 て、安全性については言
できる十分なデータが得 合には有効性に関する臨 及しているわけではな
られた場合には、有効性 床試験を省略できる場合 い。安全性に関しては、
に関する臨床試験を省略 があるとする」のは、安 別途考える必要がある。
できる場合がある。
全性の試験も省略できる
場合があると理解しても
良いか。
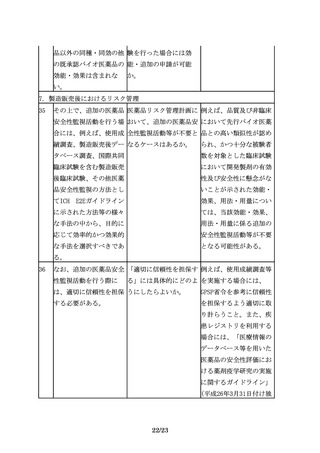
6.2 臨床的有効性の比較
26
有効性の比較を目的とし 同等性評価にあたり留意 同等性許容域は、統計学
16/23
範囲内にあることを担保
する必要がある。
5.非臨床試験
5.1 非臨床薬理試験
24
ある種の糖タンパク質の In vivo薬理試験の必要 例えば、エポエチン等で
ようにin vitroの活性が なケースを例示してほし は、シアル酸の量が多い
臨床効果と相関しない場 い。
ほど血中半減期が長くin
合には、in vivo薬理試
vivo薬理活性が高くなる
験による比較を行う。
が、in vitro試験で評価
される受容体結合能は逆
に低下することが知られ
ている。このようなケー
スでは、in vivo薬理試
験による同等性/同質性
評価が必要と考えられ
る。
6.臨床試験
25
後述する臨床薬物動態
「PK試験又はPD試験によ 指針に記載のあるとお
(PK)試験又は薬力学(PD) り目的とする臨床エンド り、有効性について同等
試験により目的とする臨 ポイントにおける同等性 /同質と推定される可能
床エンドポイントにおけ /同質性を保証できる十 性を示しているのであっ
る同等性/同質性を保証 分なデータが得られた場 て、安全性については言
できる十分なデータが得 合には有効性に関する臨 及しているわけではな
られた場合には、有効性 床試験を省略できる場合 い。安全性に関しては、
に関する臨床試験を省略 があるとする」のは、安 別途考える必要がある。
できる場合がある。
全性の試験も省略できる
場合があると理解しても
良いか。
6.2 臨床的有効性の比較
26
有効性の比較を目的とし 同等性評価にあたり留意 同等性許容域は、統計学
16/23