よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
てその妥当性を判断する
ことが求められる。従っ
て望ましいという表現に
なっている。
14
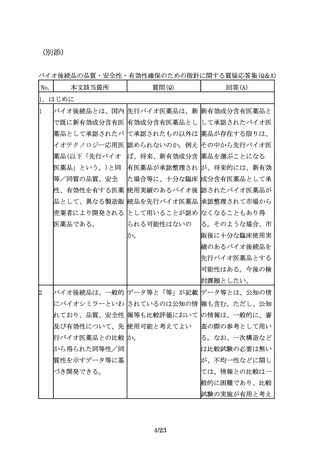
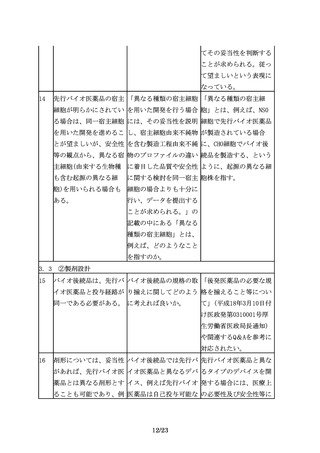
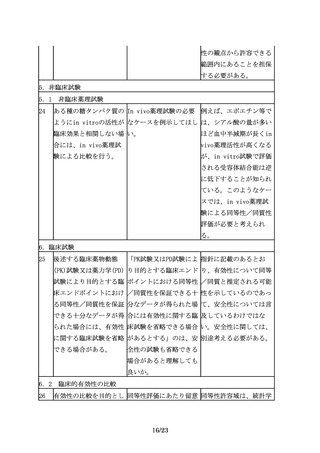
先行バイオ医薬品の宿主 「異なる種類の宿主細胞 「異なる種類の宿主細
細胞が明らかにされてい を用いた開発を行う場合 胞」とは、例えば、NS0
る場合は、同一宿主細胞 には、その妥当性を説明 細胞で先行バイオ医薬品
を用いた開発を進めるこ し、宿主細胞由来不純物 が製造されている場合
とが望ましいが、安全性 を含む製造工程由来不純 に、CHO細胞でバイオ後
等の観点から、異なる宿 物のプロファイルの違い 続品を製造する、という
主細胞(由来する生物種 に着目した品質や安全性 ように、起源の異なる細
も含む起源の異なる細
に関する検討を同一宿主 胞株を指す。
胞)を用いられる場合も 細胞の場合よりも十分に
ある。
行い、データを提出する
ことが求められる。」の
記載の中にある「異なる
種類の宿主細胞」とは、
例えば、どのようなこと
を指すのか。
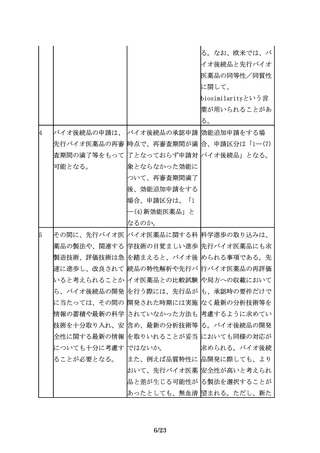
3.3 ②製剤設計
15
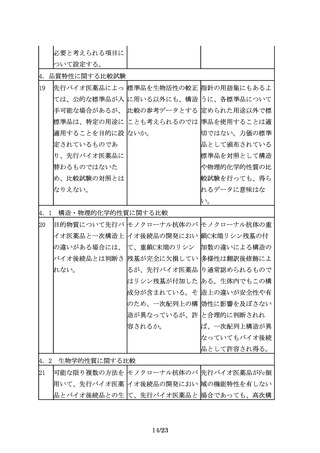
バイオ後続品は、先行バ バイオ後続品の規格の取 「後発医薬品の必要な規
イオ医薬品と投与経路が り揃えに関してどのよう 格を揃えること等につい
同一である必要がある。 に考えれば良いか。
て」(平成18年3月10日付
け医政発第0310001号厚
生労働省医政局長通知)
や関連するQ&Aを参考に
対応されたい。
16
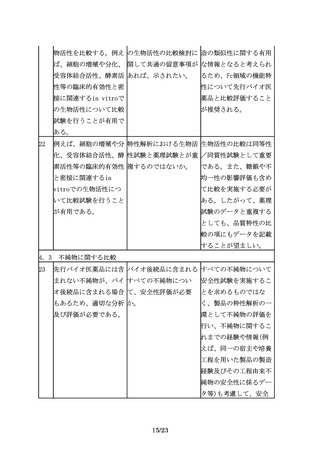
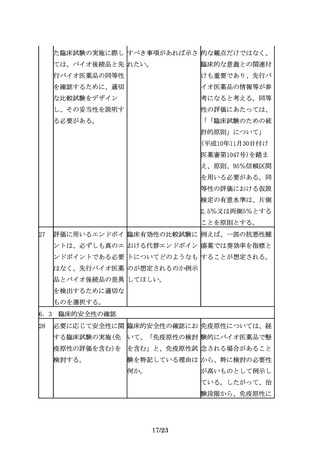
剤形については、妥当性 バイオ後続品では先行バ 先行バイオ医薬品と異な
があれば、先行バイオ医 イオ医薬品と異なるデバ るタイプのデバイスを開
薬品とは異なる剤形とす イス、例えば先行バイオ 発する場合には、医療上
ることも可能であり、例 医薬品は自己投与可能な の必要性及び安全性等に
12/23
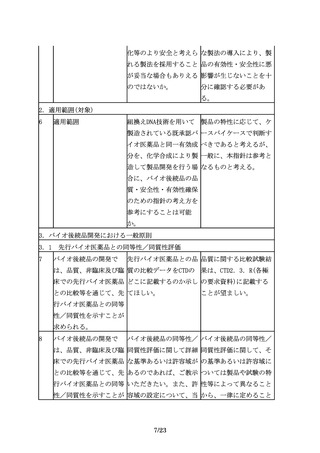
ことが求められる。従っ
て望ましいという表現に
なっている。
14
先行バイオ医薬品の宿主 「異なる種類の宿主細胞 「異なる種類の宿主細
細胞が明らかにされてい を用いた開発を行う場合 胞」とは、例えば、NS0
る場合は、同一宿主細胞 には、その妥当性を説明 細胞で先行バイオ医薬品
を用いた開発を進めるこ し、宿主細胞由来不純物 が製造されている場合
とが望ましいが、安全性 を含む製造工程由来不純 に、CHO細胞でバイオ後
等の観点から、異なる宿 物のプロファイルの違い 続品を製造する、という
主細胞(由来する生物種 に着目した品質や安全性 ように、起源の異なる細
も含む起源の異なる細
に関する検討を同一宿主 胞株を指す。
胞)を用いられる場合も 細胞の場合よりも十分に
ある。
行い、データを提出する
ことが求められる。」の
記載の中にある「異なる
種類の宿主細胞」とは、
例えば、どのようなこと
を指すのか。
3.3 ②製剤設計
15
バイオ後続品は、先行バ バイオ後続品の規格の取 「後発医薬品の必要な規
イオ医薬品と投与経路が り揃えに関してどのよう 格を揃えること等につい
同一である必要がある。 に考えれば良いか。
て」(平成18年3月10日付
け医政発第0310001号厚
生労働省医政局長通知)
や関連するQ&Aを参考に
対応されたい。
16
剤形については、妥当性 バイオ後続品では先行バ 先行バイオ医薬品と異な
があれば、先行バイオ医 イオ医薬品と異なるデバ るタイプのデバイスを開
薬品とは異なる剤形とす イス、例えば先行バイオ 発する場合には、医療上
ることも可能であり、例 医薬品は自己投与可能な の必要性及び安全性等に
12/23