よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
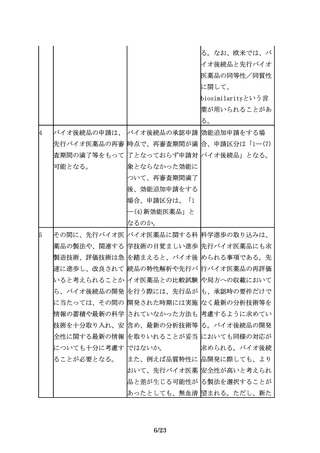
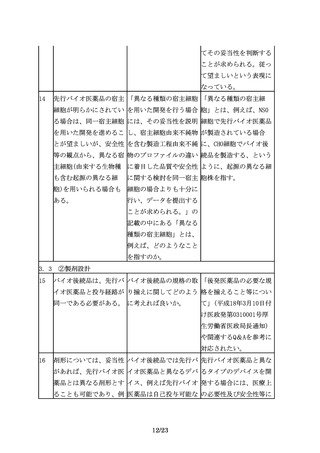
族的要因が試験結果に影
響しないと考えられる場
合には、海外で外国人を
対象に実施された臨床試
験データを使用すること
ができ、日本人を組み入
れた臨床試験を実施しな
いことで差し支えない。
なお、被験者の民族的要
因が試験結果に影響する
と考えられる場合に、日
本人を組み入れた国際共
同治験として実施する際
は、日本人症例数につい
て、「国際共同治験に関
する基本的考え方につい
て」(平成19年9月28日付
け薬食審査発第0928010
号厚生労働省医薬食品局
審査管理課長通知)に示
されている方法1及び方
法2を直接適用すること
はできないが、日本人集
団の結果と全体集団の結
果に矛盾がないことを説
明できるような計画とす
ることが必要である。
11
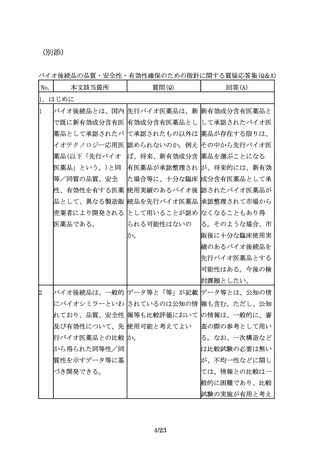
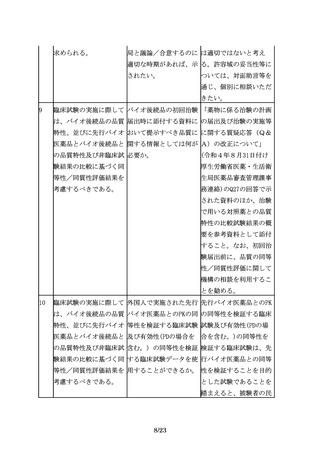
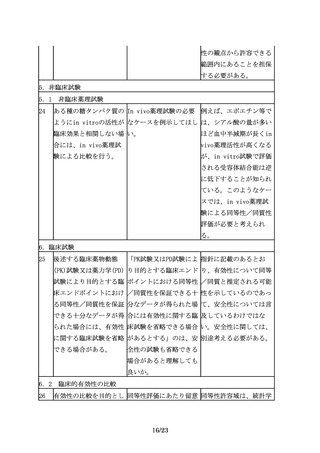
臨床試験の実施に際して 「被験者の民族的要因が 例えば、先行バイオ医薬
は、バイオ後続品の品質 試験結果に影響しないと 品における民族的要因及
特性、並びに先行バイオ 考えられる場合」とある びその影響を確認するこ
医薬品とバイオ後続品と が、どのように評価すれ とや、先行バイオ医薬品
9/23
響しないと考えられる場
合には、海外で外国人を
対象に実施された臨床試
験データを使用すること
ができ、日本人を組み入
れた臨床試験を実施しな
いことで差し支えない。
なお、被験者の民族的要
因が試験結果に影響する
と考えられる場合に、日
本人を組み入れた国際共
同治験として実施する際
は、日本人症例数につい
て、「国際共同治験に関
する基本的考え方につい
て」(平成19年9月28日付
け薬食審査発第0928010
号厚生労働省医薬食品局
審査管理課長通知)に示
されている方法1及び方
法2を直接適用すること
はできないが、日本人集
団の結果と全体集団の結
果に矛盾がないことを説
明できるような計画とす
ることが必要である。
11
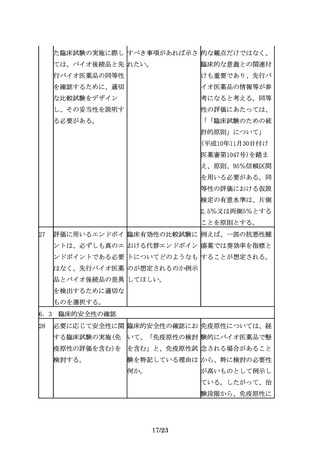
臨床試験の実施に際して 「被験者の民族的要因が 例えば、先行バイオ医薬
は、バイオ後続品の品質 試験結果に影響しないと 品における民族的要因及
特性、並びに先行バイオ 考えられる場合」とある びその影響を確認するこ
医薬品とバイオ後続品と が、どのように評価すれ とや、先行バイオ医薬品
9/23