よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
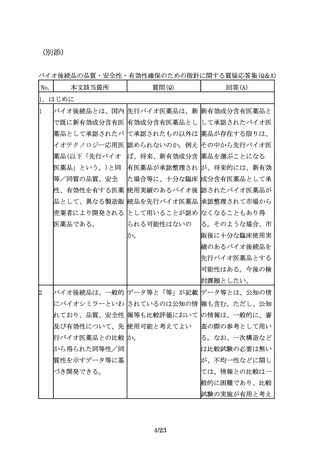
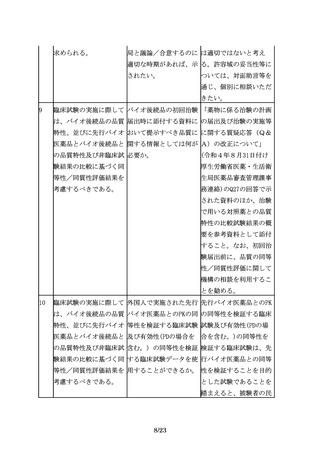
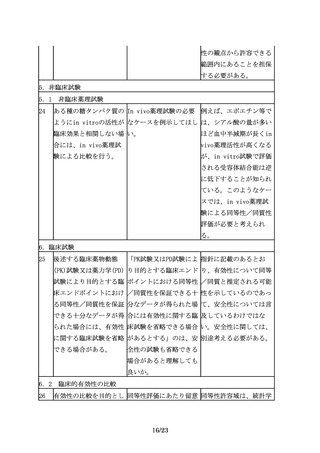
医薬品との高い類似性が
確認され、かつ、先行バ
イオ医薬品の情報や実施
された臨床試験成績等か
ら臨床試験を実施しなか
った効能・効果において
も同等の有効性及び同様
の安全性が期待できるこ
とを説明できる場合に
は、必ずしも効能・効果
毎に臨床試験を実施しな
くても、その他の効能・
効果を取得できる場合も
ある。
32
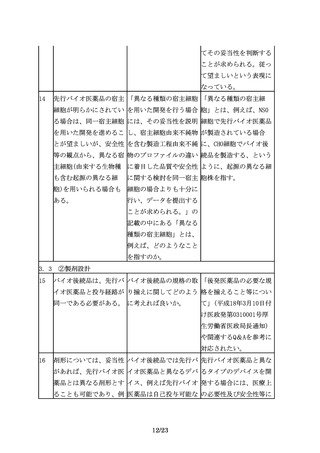
対照薬として用いた先行 先行バイオ医薬品が有す 原則として、先行バイオ
バイオ医薬品が複数の効 る複数の効能・効果及び 医薬品が有する複数の効
能・効果を有する場合、 用法・用量のうち、再審 能・効果及び用法・用量
臨床試験を実施していな 査期間や特許期間が切れ のうち、再審査期間が満
い効能・効果において
た後も、バイオ後続品が 了した全ての効能・効果
も、薬理学的に先行バイ そのうちのいくつかの効 及び用法・用量を取得す
オ医薬品と同様の作用が 能・効果及び用法・用量 ること。
期待でき、安全性プロフ を取得しないという状況
ァイルにも問題がないこ は、許容されるか。
とが説明できるのであれ
ば、それぞれの効能・効
果での用法・用量や投与
期間の異同に関わらず、
それらの効能・効果をバ
イオ後続品に付与するこ
とが可能となる(外挿)。
33
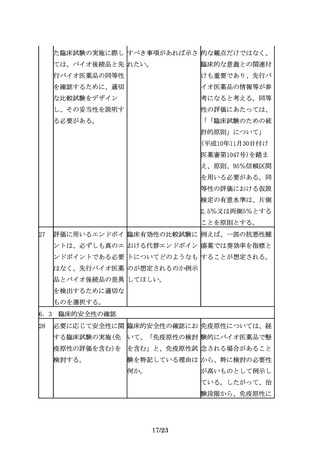
対照薬として用いた先行 先行バイオ医薬品の再審 当該臨床試験成績がバイ
20/23
確認され、かつ、先行バ
イオ医薬品の情報や実施
された臨床試験成績等か
ら臨床試験を実施しなか
った効能・効果において
も同等の有効性及び同様
の安全性が期待できるこ
とを説明できる場合に
は、必ずしも効能・効果
毎に臨床試験を実施しな
くても、その他の効能・
効果を取得できる場合も
ある。
32
対照薬として用いた先行 先行バイオ医薬品が有す 原則として、先行バイオ
バイオ医薬品が複数の効 る複数の効能・効果及び 医薬品が有する複数の効
能・効果を有する場合、 用法・用量のうち、再審 能・効果及び用法・用量
臨床試験を実施していな 査期間や特許期間が切れ のうち、再審査期間が満
い効能・効果において
た後も、バイオ後続品が 了した全ての効能・効果
も、薬理学的に先行バイ そのうちのいくつかの効 及び用法・用量を取得す
オ医薬品と同様の作用が 能・効果及び用法・用量 ること。
期待でき、安全性プロフ を取得しないという状況
ァイルにも問題がないこ は、許容されるか。
とが説明できるのであれ
ば、それぞれの効能・効
果での用法・用量や投与
期間の異同に関わらず、
それらの効能・効果をバ
イオ後続品に付与するこ
とが可能となる(外挿)。
33
対照薬として用いた先行 先行バイオ医薬品の再審 当該臨床試験成績がバイ
20/23