よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
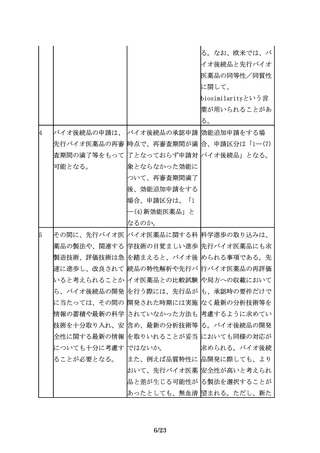
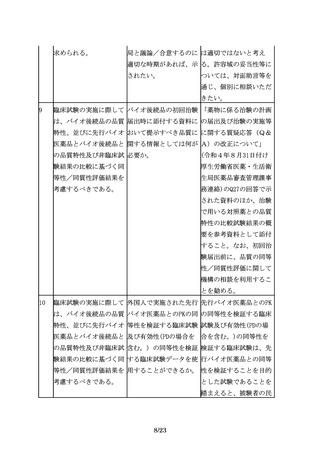
物活性を比較する。例え の生物活性の比較検討に 造の類似性に関する有用
ば、細胞の増殖や分化、 関して共通の留意事項が な情報となると考えられ
受容体結合活性、酵素活 あれば、示されたい。
るため、Fc領域の機能特
性等の臨床的有効性と密
性について先行バイオ医
接に関連するin vitroで
薬品と比較評価すること
の生物活性について比較
が推奨される。
試験を行うことが有用で
ある。
22
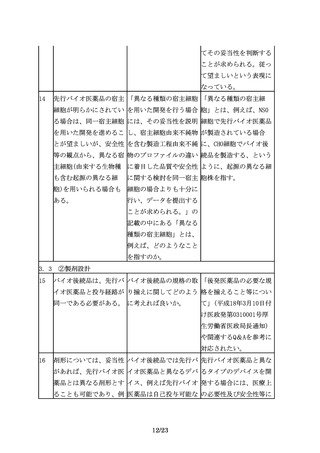
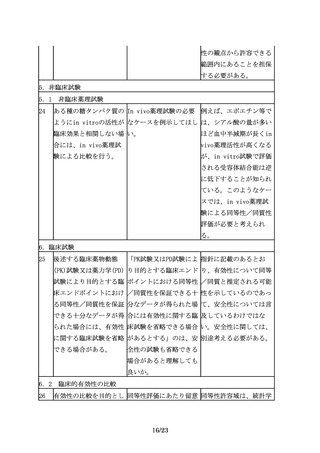
例えば、細胞の増殖や分 特性解析における生物活 生物活性の比較は同等性
化、受容体結合活性、酵 性試験と薬理試験とが重 /同質性試験として重要
素活性等の臨床的有効性 複するのではないか。
である。また、糖鎖や不
と密接に関連するin
均一性の影響評価も含め
vitroでの生物活性につ
て比較を実施する必要が
いて比較試験を行うこと
ある。したがって、薬理
が有用である。
試験のデータと重複する
としても、品質特性の比
較の項にもデータを記載
することが望ましい。
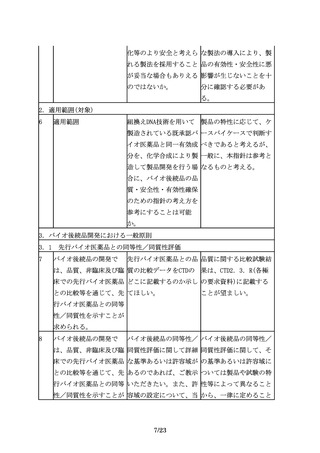
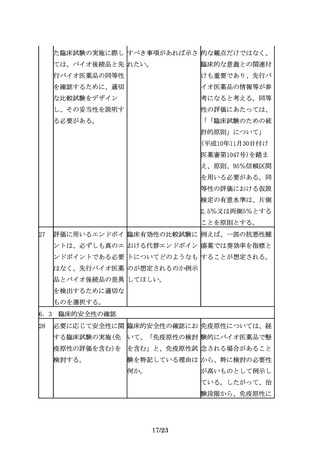
4.3 不純物に関する比較
23
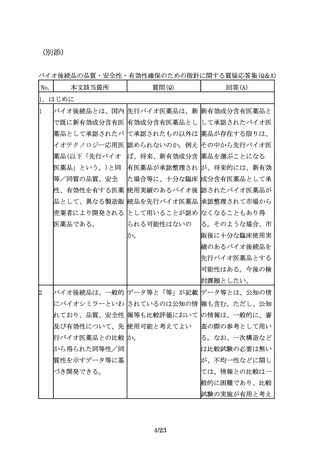
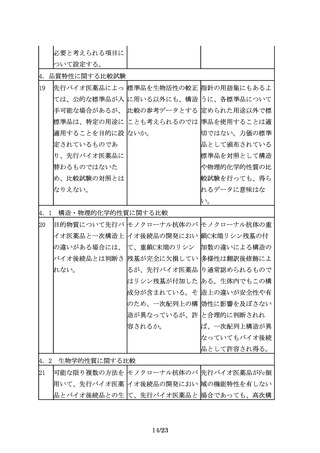
先行バイオ医薬品には含 バイオ後続品に含まれる すべての不純物について
まれない不純物が、バイ すべての不純物につい
安全性試験を実施するこ
オ後続品に含まれる場合 て、安全性評価が必要
とを求めるものではな
もあるため、適切な分析 か。
く、製品の特性解析の一
及び評価が必要である。
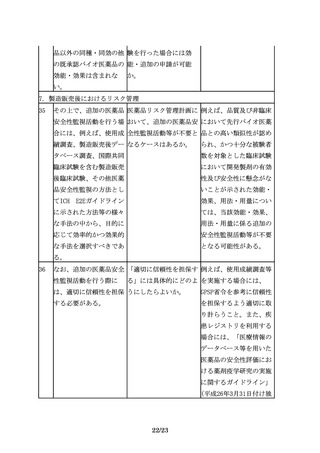
環として不純物の評価を
行い、不純物に関するこ
れまでの経験や情報(例
えば、同一の宿主や培養
工程を用いた製品の製造
経験及びその工程由来不
純物の安全性に係るデー
タ等)も考慮して、安全
15/23
ば、細胞の増殖や分化、 関して共通の留意事項が な情報となると考えられ
受容体結合活性、酵素活 あれば、示されたい。
るため、Fc領域の機能特
性等の臨床的有効性と密
性について先行バイオ医
接に関連するin vitroで
薬品と比較評価すること
の生物活性について比較
が推奨される。
試験を行うことが有用で
ある。
22
例えば、細胞の増殖や分 特性解析における生物活 生物活性の比較は同等性
化、受容体結合活性、酵 性試験と薬理試験とが重 /同質性試験として重要
素活性等の臨床的有効性 複するのではないか。
である。また、糖鎖や不
と密接に関連するin
均一性の影響評価も含め
vitroでの生物活性につ
て比較を実施する必要が
いて比較試験を行うこと
ある。したがって、薬理
が有用である。
試験のデータと重複する
としても、品質特性の比
較の項にもデータを記載
することが望ましい。
4.3 不純物に関する比較
23
先行バイオ医薬品には含 バイオ後続品に含まれる すべての不純物について
まれない不純物が、バイ すべての不純物につい
安全性試験を実施するこ
オ後続品に含まれる場合 て、安全性評価が必要
とを求めるものではな
もあるため、適切な分析 か。
く、製品の特性解析の一
及び評価が必要である。
環として不純物の評価を
行い、不純物に関するこ
れまでの経験や情報(例
えば、同一の宿主や培養
工程を用いた製品の製造
経験及びその工程由来不
純物の安全性に係るデー
タ等)も考慮して、安全
15/23