よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別添)
バイオ後続品の品質・安全性・有効性確保のための指針に関する質疑応答集(Q&A)
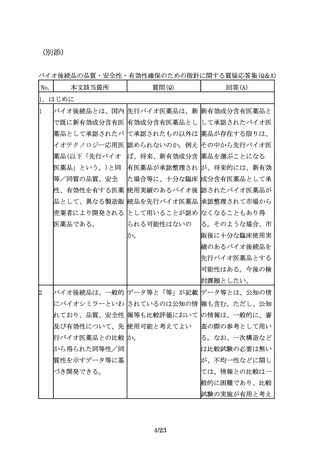
No.
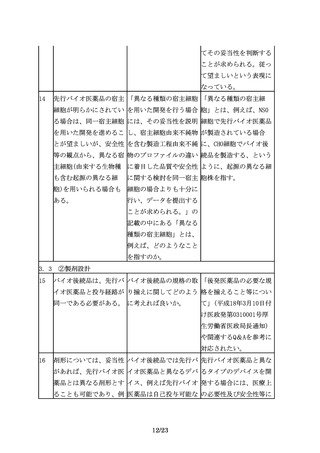
本文該当箇所
質問(Q)
回答(A)
1.はじめに
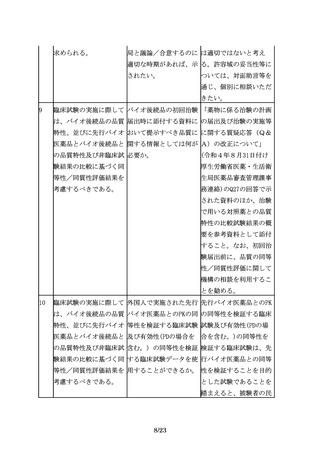
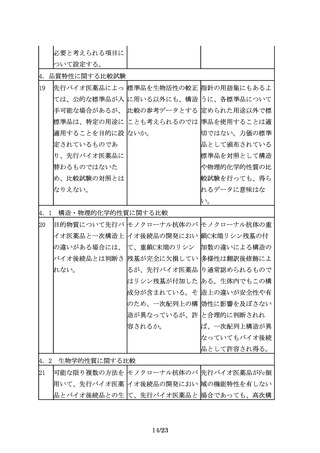
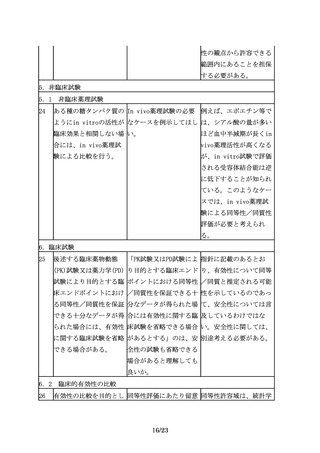
1
バイオ後続品とは、国内 先行バイオ医薬品は、新 新有効成分含有医薬品と
で既に新有効成分含有医 有効成分含有医薬品とし して承認されたバイオ医
薬品として承認されたバ て承認されたもの以外は 薬品が存在する限りは、
イオテクノロジー応用医 認められないのか。例え その中から先行バイオ医
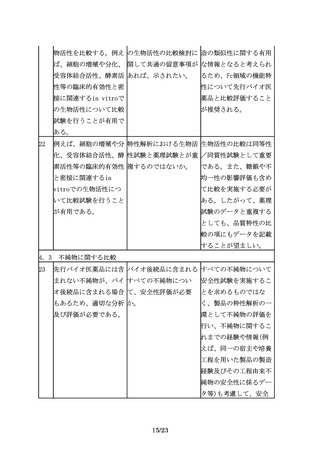
薬品(以下「先行バイオ ば、将来、新有効成分含 薬品を選ぶことになる
医薬品」という。)と同 有医薬品が承認整理され が、将来的には、新有効
等/同質の品質、安全
た場合等に、十分な臨床 成分含有医薬品として承
性、有効性を有する医薬 使用実績のあるバイオ後 認されたバイオ医薬品が
品として、異なる製造販 続品を先行バイオ医薬品 承認整理されて市場から
売業者により開発される として用いることが認め なくなることもあり得
医薬品である。
られる可能性はないの
る。そのような場合、市
か。
販後に十分な臨床使用実
績のあるバイオ後続品を
先行バイオ医薬品とする
可能性はある。今後の検
討課題としたい。
2
バイオ後続品は、一般的 データ等と「等」が記載 データ等とは、公知の情
にバイオシミラーといわ されているのは公知の情 報も含む。ただし、公知
れており、品質、安全性 報等も比較評価において の情報は、一般的に、審
及び有効性について、先 使用可能と考えてよい
査の際の参考として用い
行バイオ医薬品との比較 か。
る。なお、一次構造など
から得られた同等性/同
は比較試験の必要は無い
質性を示すデータ等に基
が、不均一性などに関し
づき開発できる。
ては、情報との比較は一
般的に困難であり、比較
試験の実施が有用と考え
4/23
バイオ後続品の品質・安全性・有効性確保のための指針に関する質疑応答集(Q&A)
No.
本文該当箇所
質問(Q)
回答(A)
1.はじめに
1
バイオ後続品とは、国内 先行バイオ医薬品は、新 新有効成分含有医薬品と
で既に新有効成分含有医 有効成分含有医薬品とし して承認されたバイオ医
薬品として承認されたバ て承認されたもの以外は 薬品が存在する限りは、
イオテクノロジー応用医 認められないのか。例え その中から先行バイオ医
薬品(以下「先行バイオ ば、将来、新有効成分含 薬品を選ぶことになる
医薬品」という。)と同 有医薬品が承認整理され が、将来的には、新有効
等/同質の品質、安全
た場合等に、十分な臨床 成分含有医薬品として承
性、有効性を有する医薬 使用実績のあるバイオ後 認されたバイオ医薬品が
品として、異なる製造販 続品を先行バイオ医薬品 承認整理されて市場から
売業者により開発される として用いることが認め なくなることもあり得
医薬品である。
られる可能性はないの
る。そのような場合、市
か。
販後に十分な臨床使用実
績のあるバイオ後続品を
先行バイオ医薬品とする
可能性はある。今後の検
討課題としたい。
2
バイオ後続品は、一般的 データ等と「等」が記載 データ等とは、公知の情
にバイオシミラーといわ されているのは公知の情 報も含む。ただし、公知
れており、品質、安全性 報等も比較評価において の情報は、一般的に、審
及び有効性について、先 使用可能と考えてよい
査の際の参考として用い
行バイオ医薬品との比較 か。
る。なお、一次構造など
から得られた同等性/同
は比較試験の必要は無い
質性を示すデータ等に基
が、不均一性などに関し
づき開発できる。
ては、情報との比較は一
般的に困難であり、比較
試験の実施が有用と考え
4/23