よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
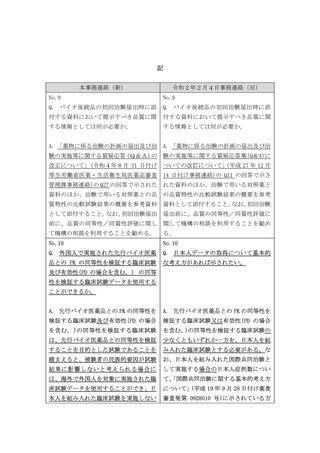
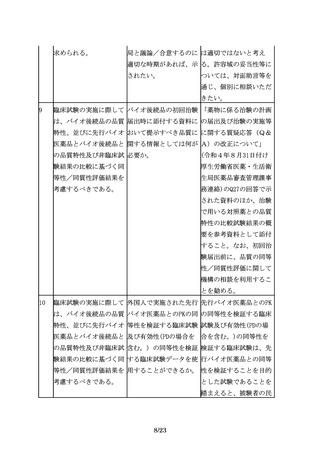
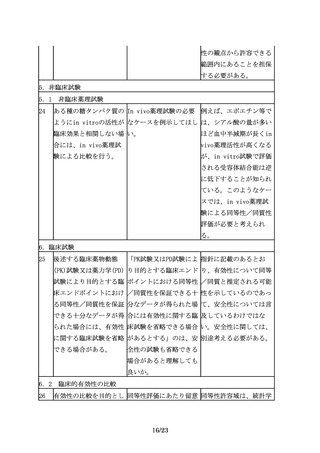
た臨床試験の実施に際し すべき事項があれば示さ 的な観点だけではなく、
ては、バイオ後続品と先 れたい。
臨床的な意義との関連付
行バイオ医薬品の同等性
けも重要であり、先行バ
を確認するために、適切
イオ医薬品の情報等が参
な比較試験をデザイン
考になると考える。同等
し、その妥当性を説明す
性の評価にあたっては、
る必要がある。
「「臨床試験のための統
計的原則」について」
(平成10年11月30日付け
医薬審第1047号)を踏ま
え、原則、95%信頼区間
を用いる必要がある。同
等性の評価における仮説
検定の有意水準は、片側
2.5%又は両側5%とする
ことを原則とする。
27
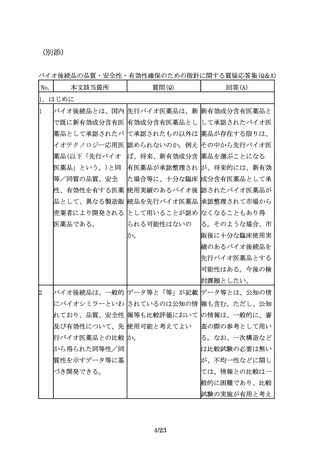
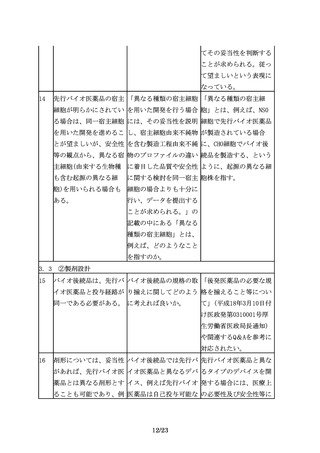
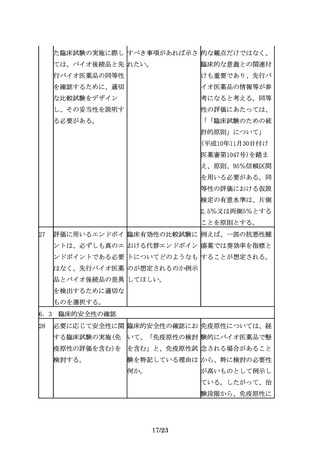
評価に用いるエンドポイ 臨床有効性の比較試験に 例えば、一部の抗悪性腫
ントは、必ずしも真のエ おける代替エンドポイン 瘍薬では奏効率を指標と
ンドポイントである必要 トについてどのようなも することが想定される。
はなく、先行バイオ医薬 のが想定されるのか例示
品とバイオ後続品の差異 してほしい。
を検出するために適切な
ものを選択する。
6.3 臨床的安全性の確認
28
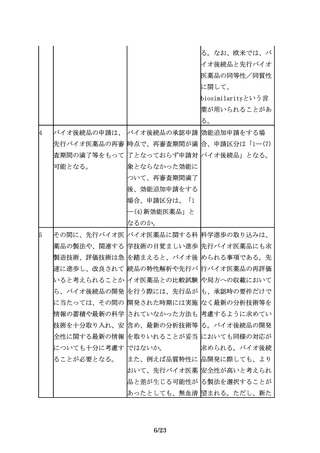
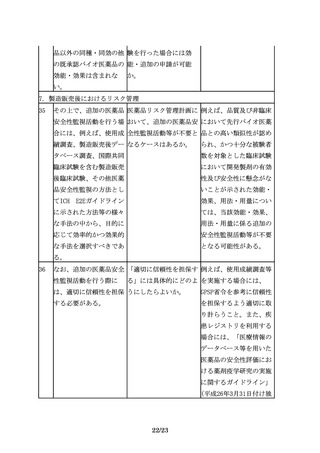
必要に応じて安全性に関 臨床的安全性の確認にお 免疫原性については、経
する臨床試験の実施(免 いて、「免疫原性の検討 験的にバイオ医薬品で懸
疫原性の評価を含む)を を含む」と、免疫原性試 念される場合があること
検討する。
験を特記している理由は から、特に検討の必要性
何か。
が高いものとして例示し
ている。したがって、治
験段階から、免疫原性に
17/23
ては、バイオ後続品と先 れたい。
臨床的な意義との関連付
行バイオ医薬品の同等性
けも重要であり、先行バ
を確認するために、適切
イオ医薬品の情報等が参
な比較試験をデザイン
考になると考える。同等
し、その妥当性を説明す
性の評価にあたっては、
る必要がある。
「「臨床試験のための統
計的原則」について」
(平成10年11月30日付け
医薬審第1047号)を踏ま
え、原則、95%信頼区間
を用いる必要がある。同
等性の評価における仮説
検定の有意水準は、片側
2.5%又は両側5%とする
ことを原則とする。
27
評価に用いるエンドポイ 臨床有効性の比較試験に 例えば、一部の抗悪性腫
ントは、必ずしも真のエ おける代替エンドポイン 瘍薬では奏効率を指標と
ンドポイントである必要 トについてどのようなも することが想定される。
はなく、先行バイオ医薬 のが想定されるのか例示
品とバイオ後続品の差異 してほしい。
を検出するために適切な
ものを選択する。
6.3 臨床的安全性の確認
28
必要に応じて安全性に関 臨床的安全性の確認にお 免疫原性については、経
する臨床試験の実施(免 いて、「免疫原性の検討 験的にバイオ医薬品で懸
疫原性の評価を含む)を を含む」と、免疫原性試 念される場合があること
検討する。
験を特記している理由は から、特に検討の必要性
何か。
が高いものとして例示し
ている。したがって、治
験段階から、免疫原性に
17/23