よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
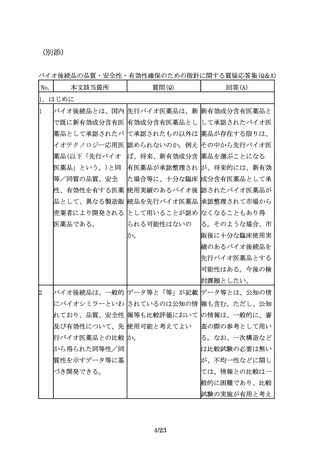
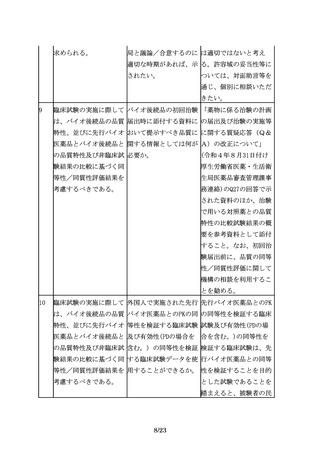
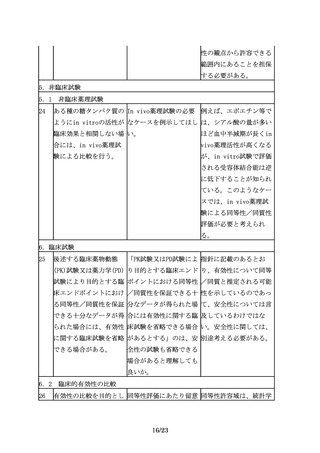
えば、先行バイオ医薬品 シリンジ製剤のみ製造販 ついて確認が必要となる
が凍結乾燥製剤であるの 売しているが、バイオ後 場合があるため、対面助
に対してバイオ後続品は 続品ではシリンジ製剤に 言等を通じ、規制当局に
液剤とすることが認めら 加えてペンタイプの製剤 相談することが望まし
れる場合もある。
を開発する場合等で留意 い。
点はあるか。
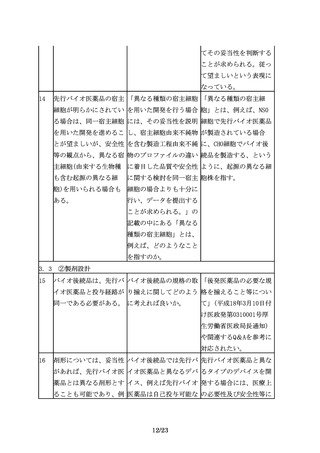
3.3 ③規格及び試験方法
17
規格及び試験方法は、バ 先行バイオ医薬品を開発 開発初期には先行バイオ
イオ後続品の品質特性の 品の標準物質として用い 医薬品を標準物質とする
うち、有効成分の確認に ることは可能か。
ことがやむを得ない場合
必要な項目や、保存中に
もあると考える。しか
変化する可能性の高い項
し、先行バイオ医薬品の
目、製造工程中での評価
品質に関する情報を全て
が困難な項目等、製造工
入手することは一般的に
程での関連する工程パラ
困難であり、標準物質と
メータの管理に加えて、
位置づけたとしてもその
原薬あるいは製剤での試
品質を自ら管理すること
験が必要と考えられる項
には限界があるため、自
目について設定する。
家の標準物質を可能な限
り早期に確立する必要が
ある。
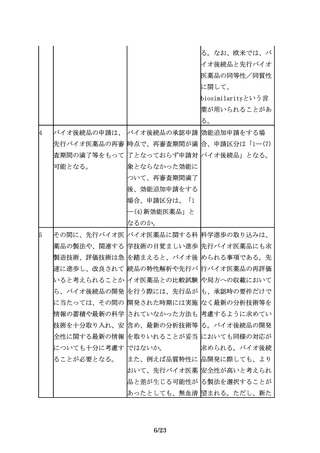
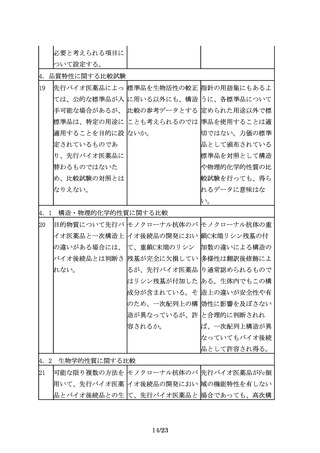
18
規格及び試験方法は、バ 先行バイオ医薬品で用い 既存の生物試験と原理の
イオ後続品の品質特性の られていた生物試験につ 異同や相関性を考慮し、
うち、有効成分の確認に いて、より精度の高い試 試験法の妥当性が確認さ
必要な項目や、保存中に 験法への代替は認められ れるならば代替は認めら
変化する可能性の高い項 るのか。
目、製造工程中での評価
が困難な項目等、製造工
程での関連する工程パラ
メータの管理に加えて、
原薬又は製剤での試験が
13/23
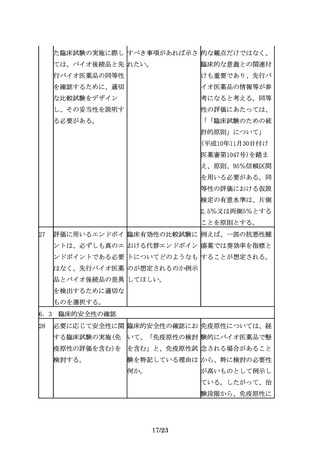
れる。
が凍結乾燥製剤であるの 売しているが、バイオ後 場合があるため、対面助
に対してバイオ後続品は 続品ではシリンジ製剤に 言等を通じ、規制当局に
液剤とすることが認めら 加えてペンタイプの製剤 相談することが望まし
れる場合もある。
を開発する場合等で留意 い。
点はあるか。
3.3 ③規格及び試験方法
17
規格及び試験方法は、バ 先行バイオ医薬品を開発 開発初期には先行バイオ
イオ後続品の品質特性の 品の標準物質として用い 医薬品を標準物質とする
うち、有効成分の確認に ることは可能か。
ことがやむを得ない場合
必要な項目や、保存中に
もあると考える。しか
変化する可能性の高い項
し、先行バイオ医薬品の
目、製造工程中での評価
品質に関する情報を全て
が困難な項目等、製造工
入手することは一般的に
程での関連する工程パラ
困難であり、標準物質と
メータの管理に加えて、
位置づけたとしてもその
原薬あるいは製剤での試
品質を自ら管理すること
験が必要と考えられる項
には限界があるため、自
目について設定する。
家の標準物質を可能な限
り早期に確立する必要が
ある。
18
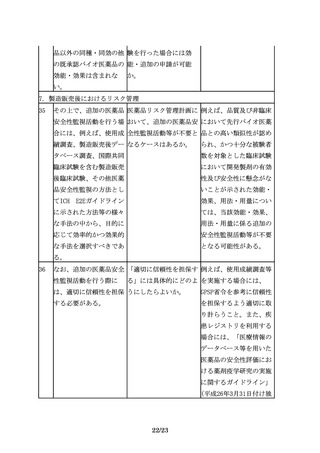
規格及び試験方法は、バ 先行バイオ医薬品で用い 既存の生物試験と原理の
イオ後続品の品質特性の られていた生物試験につ 異同や相関性を考慮し、
うち、有効成分の確認に いて、より精度の高い試 試験法の妥当性が確認さ
必要な項目や、保存中に 験法への代替は認められ れるならば代替は認めら
変化する可能性の高い項 るのか。
目、製造工程中での評価
が困難な項目等、製造工
程での関連する工程パラ
メータの管理に加えて、
原薬又は製剤での試験が
13/23
れる。