よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
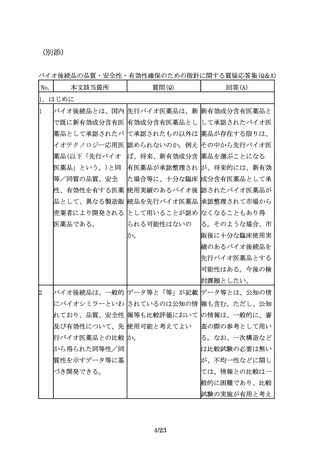
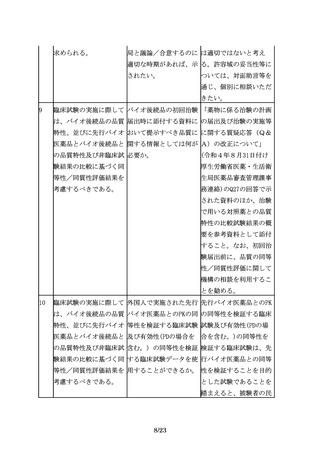
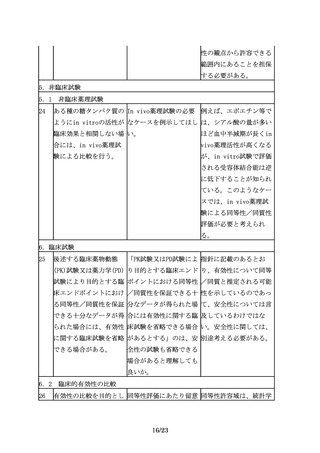
品以外の同種・同効の他 験を行った場合には効
の既承認バイオ医薬品の 能・追加の申請が可能
効能・効果は含まれな
か。
い。
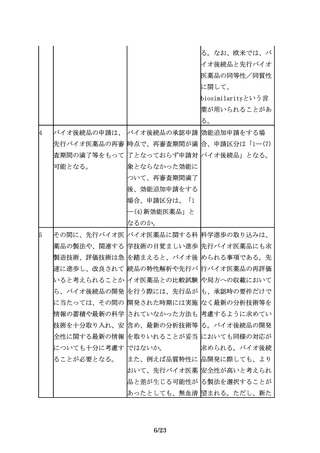
7.製造販売後におけるリスク管理
35
その上で、追加の医薬品 医薬品リスク管理計画に 例えば、品質及び非臨床
安全性監視活動を行う場 おいて、追加の医薬品安 において先行バイオ医薬
合には、例えば、使用成 全性監視活動等が不要と 品との高い類似性が認め
績調査、製造販売後デー なるケースはあるか。
られ、かつ十分な被験者
タベース調査、国際共同
数を対象とした臨床試験
臨床試験を含む製造販売
において開発製剤の有効
後臨床試験、その他医薬
性及び安全性に懸念がな
品安全性監視の方法とし
いことが示された効能・
てICH
E2Eガイドライン
効果、用法・用量につい
に示された方法等の様々
ては、当該効能・効果、
な手法の中から、目的に
用法・用量に係る追加の
応じて効率的かつ効果的
安全性監視活動等が不要
な手法を選択すべきであ
となる可能性がある。
る。
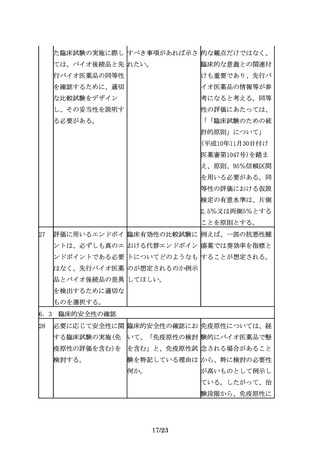
36
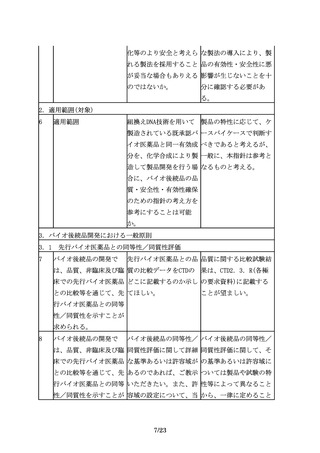
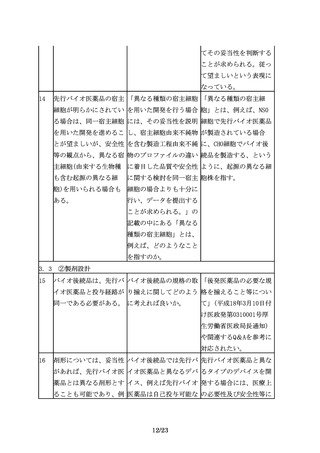
なお、追加の医薬品安全 「適切に信頼性を担保す 例えば、使用成績調査等
性監視活動を行う際に
る」には具体的にどのよ を実施する場合には、
は、適切に信頼性を担保 うにしたらよいか。
GPSP省令を参考に信頼性
する必要がある。
を担保するよう適切に取
り計らうこと。また、疾
患レジストリを利用する
場合には、「医療情報の
データベース等を用いた
医薬品の安全性評価にお
ける薬剤疫学研究の実施
に関するガイドライン」
(平成26年3月31日付け独
22/23
の既承認バイオ医薬品の 能・追加の申請が可能
効能・効果は含まれな
か。
い。
7.製造販売後におけるリスク管理
35
その上で、追加の医薬品 医薬品リスク管理計画に 例えば、品質及び非臨床
安全性監視活動を行う場 おいて、追加の医薬品安 において先行バイオ医薬
合には、例えば、使用成 全性監視活動等が不要と 品との高い類似性が認め
績調査、製造販売後デー なるケースはあるか。
られ、かつ十分な被験者
タベース調査、国際共同
数を対象とした臨床試験
臨床試験を含む製造販売
において開発製剤の有効
後臨床試験、その他医薬
性及び安全性に懸念がな
品安全性監視の方法とし
いことが示された効能・
てICH
E2Eガイドライン
効果、用法・用量につい
に示された方法等の様々
ては、当該効能・効果、
な手法の中から、目的に
用法・用量に係る追加の
応じて効率的かつ効果的
安全性監視活動等が不要
な手法を選択すべきであ
となる可能性がある。
る。
36
なお、追加の医薬品安全 「適切に信頼性を担保す 例えば、使用成績調査等
性監視活動を行う際に
る」には具体的にどのよ を実施する場合には、
は、適切に信頼性を担保 うにしたらよいか。
GPSP省令を参考に信頼性
する必要がある。
を担保するよう適切に取
り計らうこと。また、疾
患レジストリを利用する
場合には、「医療情報の
データベース等を用いた
医薬品の安全性評価にお
ける薬剤疫学研究の実施
に関するガイドライン」
(平成26年3月31日付け独
22/23