よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
化等のより安全と考えら な製法の導入により、製
れる製法を採用すること 品の有効性・安全性に悪
が妥当な場合もありえる 影響が生じないことを十
のではないか。
分に確認する必要があ
る。
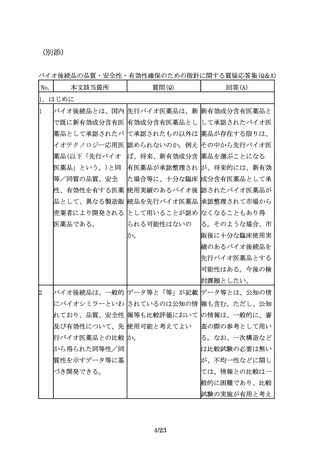
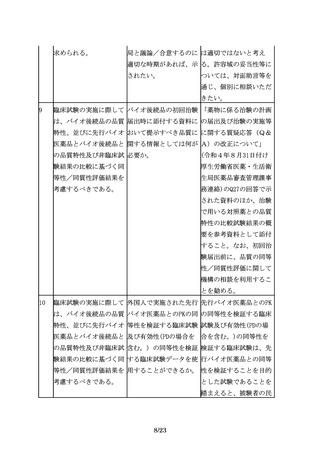
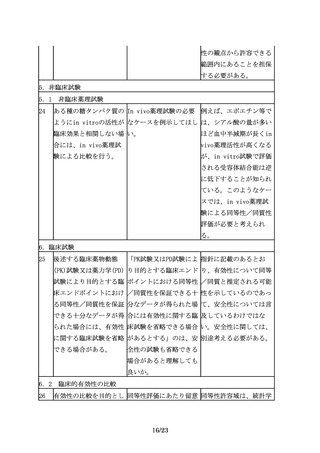
2.適用範囲(対象)
6
適用範囲
組換えDNA技術を用いて 製品の特性に応じて、ケ
製造されている既承認バ ースバイケースで判断す
イオ医薬品と同一有効成 べきであると考えるが、
分を、化学合成により製 一般に、本指針は参考と
造して製品開発を行う場 なるものと考える。
合に、バイオ後続品の品
質・安全性・有効性確保
のための指針の考え方を
参考にすることは可能
か。
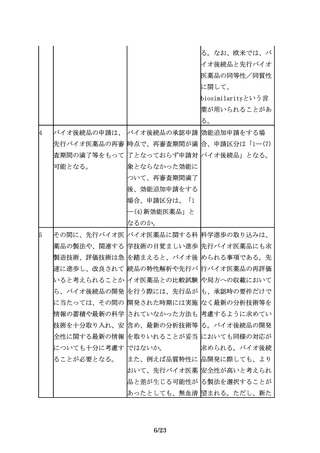
3.バイオ後続品開発における一般原則
3.1 先行バイオ医薬品との同等性/同質性評価
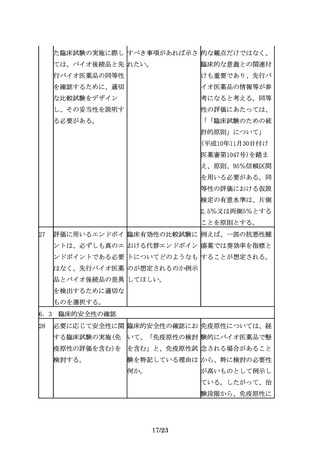
7
バイオ後続品の開発で
先行バイオ医薬品との品 品質に関する比較試験結
は、品質、非臨床及び臨 質の比較データをCTDの 果は、CTD2.3.R(各極
床での先行バイオ医薬品 どこに記載するのか示し の要求資料)に記載する
との比較等を通じて、先 てほしい。
ことが望ましい。
行バイオ医薬品との同等
性/同質性を示すことが
求められる。
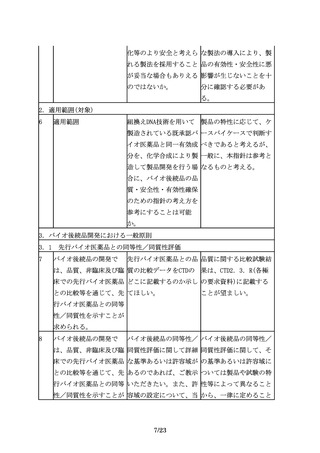
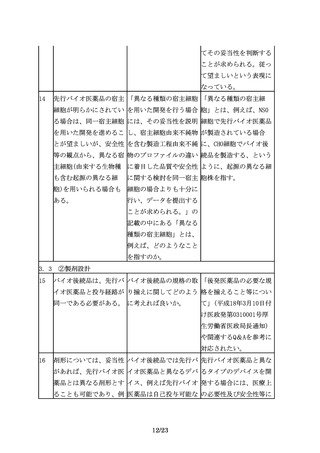
8
バイオ後続品の開発で
バイオ後続品の同等性/ バイオ後続品の同等性/
は、品質、非臨床及び臨 同質性評価に関して詳細 同質性評価に関して、そ
床での先行バイオ医薬品 な基準あるいは許容域が の基準あるいは許容域に
との比較等を通じて、先 あるのであれば、ご教示 ついては製品や試験の特
行バイオ医薬品との同等 いただきたい。また、許 性等によって異なること
性/同質性を示すことが 容域の設定について、当 から、一律に定めること
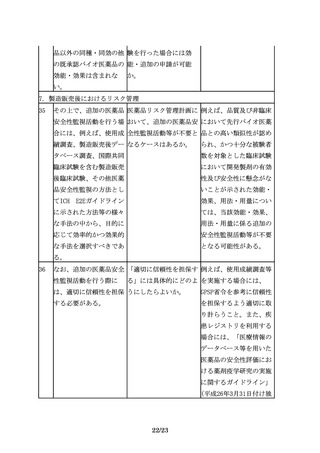
7/23
れる製法を採用すること 品の有効性・安全性に悪
が妥当な場合もありえる 影響が生じないことを十
のではないか。
分に確認する必要があ
る。
2.適用範囲(対象)
6
適用範囲
組換えDNA技術を用いて 製品の特性に応じて、ケ
製造されている既承認バ ースバイケースで判断す
イオ医薬品と同一有効成 べきであると考えるが、
分を、化学合成により製 一般に、本指針は参考と
造して製品開発を行う場 なるものと考える。
合に、バイオ後続品の品
質・安全性・有効性確保
のための指針の考え方を
参考にすることは可能
か。
3.バイオ後続品開発における一般原則
3.1 先行バイオ医薬品との同等性/同質性評価
7
バイオ後続品の開発で
先行バイオ医薬品との品 品質に関する比較試験結
は、品質、非臨床及び臨 質の比較データをCTDの 果は、CTD2.3.R(各極
床での先行バイオ医薬品 どこに記載するのか示し の要求資料)に記載する
との比較等を通じて、先 てほしい。
ことが望ましい。
行バイオ医薬品との同等
性/同質性を示すことが
求められる。
8
バイオ後続品の開発で
バイオ後続品の同等性/ バイオ後続品の同等性/
は、品質、非臨床及び臨 同質性評価に関して詳細 同質性評価に関して、そ
床での先行バイオ医薬品 な基準あるいは許容域が の基準あるいは許容域に
との比較等を通じて、先 あるのであれば、ご教示 ついては製品や試験の特
行バイオ医薬品との同等 いただきたい。また、許 性等によって異なること
性/同質性を示すことが 容域の設定について、当 から、一律に定めること
7/23