よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
られる。
3
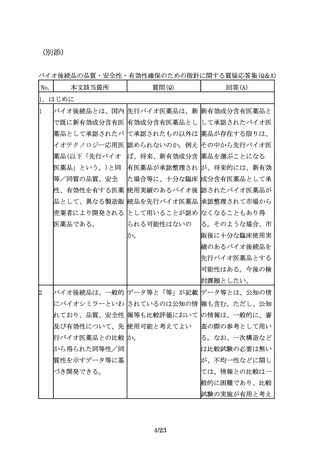
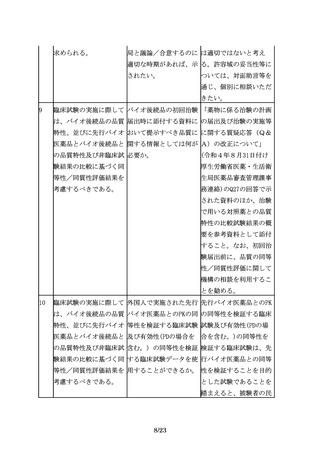
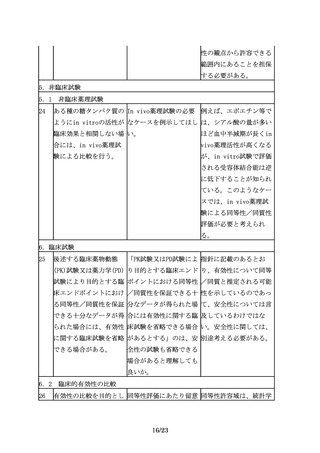
バイオ後続品は、一般的 バイオ後続品と先行バイ 同等性/同質性は、バイ
にバイオシミラーといわ オ医薬品の同等性/同質 オ医薬品の製法変更に係
れており、品質、安全性 性評価は、製法変更前後 るICHQ5E通知において、
及び有効性について、先 での同等性/同質性評価 comparabilityの日本語
行バイオ医薬品との比較 と同じことを指している 訳として用いられた用語
から得られた同等性/同 か。また、同等性/同質 である。先行バイオ医薬
質性を示すデータ等に基 性は、biosimilarityと 品とバイオ後続品の品
づき開発できる。
同義であるか。
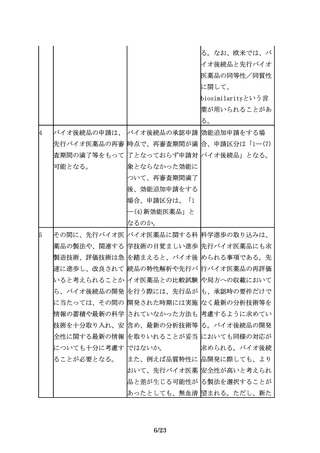
質・有効性・安全性の比
較評価には、製法変更前
後の製品の品質・有効
性・安全性の比較評価と
同様の考え方を適用可能
であることから、バイオ
後続品においても、同じ
言葉が用いられている。
ただし、製法変更前後の
同等性/同質性評価で
は、変更前後の製法及び
それにより製造された製
品の規格及び試験方法等
に関する情報が全て明ら
かな状況で比較を行うの
に対して、先行バイオ医
薬品とバイオ後続品の比
較では、先行バイオ医薬
品の製法に関する情報が
なく、その品質に関する
情報も限られているた
め、必要とされる比較試
験の内容や程度は異な
5/23
3
バイオ後続品は、一般的 バイオ後続品と先行バイ 同等性/同質性は、バイ
にバイオシミラーといわ オ医薬品の同等性/同質 オ医薬品の製法変更に係
れており、品質、安全性 性評価は、製法変更前後 るICHQ5E通知において、
及び有効性について、先 での同等性/同質性評価 comparabilityの日本語
行バイオ医薬品との比較 と同じことを指している 訳として用いられた用語
から得られた同等性/同 か。また、同等性/同質 である。先行バイオ医薬
質性を示すデータ等に基 性は、biosimilarityと 品とバイオ後続品の品
づき開発できる。
同義であるか。
質・有効性・安全性の比
較評価には、製法変更前
後の製品の品質・有効
性・安全性の比較評価と
同様の考え方を適用可能
であることから、バイオ
後続品においても、同じ
言葉が用いられている。
ただし、製法変更前後の
同等性/同質性評価で
は、変更前後の製法及び
それにより製造された製
品の規格及び試験方法等
に関する情報が全て明ら
かな状況で比較を行うの
に対して、先行バイオ医
薬品とバイオ後続品の比
較では、先行バイオ医薬
品の製法に関する情報が
なく、その品質に関する
情報も限られているた
め、必要とされる比較試
験の内容や程度は異な
5/23