よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
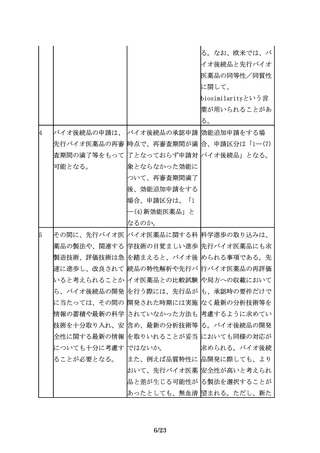
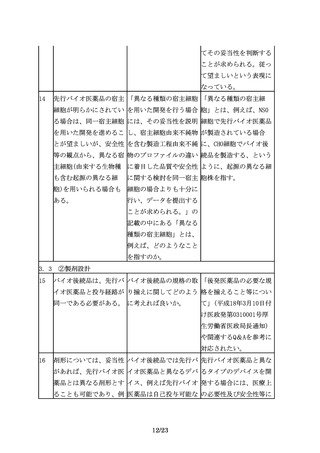
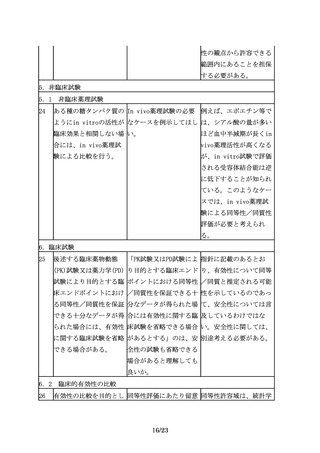
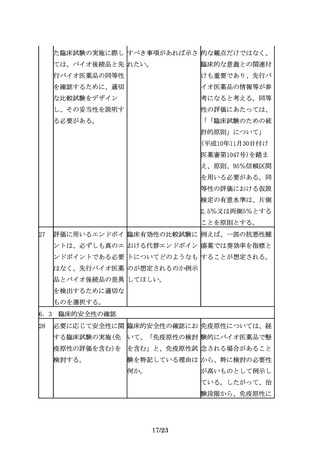
オ医薬品の同等性/同質
性評価にあたっては、比
較する先行バイオ医薬品
の品質特性の変動に留意
する必要がある。開発途
中で先行バイオ医薬品の
製法が変更されることも
あるが、製法の変更前の
ものを先行バイオ医薬品
として、バイオ後続品を
開発、承認申請すること
は可能である。
3.3 バイオ後続品の製法開発及び品質管理戦略構築にあたっての留意事項
3.3 ①宿主細胞株
13
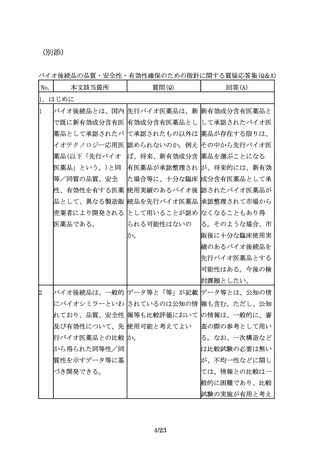
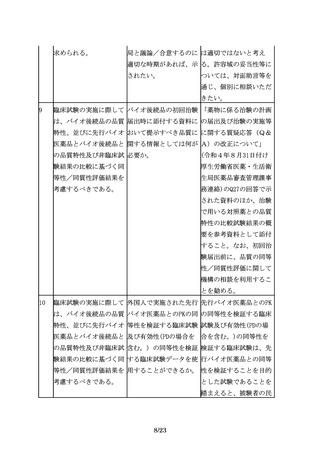
先行バイオ医薬品の宿主 指針では、「・・・、先 「同一宿主細胞」とは、
細胞が明らかにされてい 行バイオ医薬品の宿主細 例えば、先行バイオ医薬
る場合は、同一宿主細胞 胞が明らかにされている 品がCHO細胞で製造され
を用いた開発を進めるこ 場合は同一宿主細胞を用 ている場合、CHO細胞の
とが望ましいが、安全性 いた開発を進めることが ことを指すが、CHO細胞
等の観点から、異なる宿 望ましい。」とあるが、 の中の亜種まで一致させ
主細胞(由来する生物種 「同一宿主細胞」とは、 ることができなくてもや
も含む起源の異なる細
例えば、どの程度の同一 むを得ないと考えられ
胞)が用いられる場合も 性が考えられるのか。ま る。一方で、先行バイオ
ある。
た、「望ましい」とした 医薬品がある細胞を用い
趣旨は何か。
ていることが明らかな場
合でも、免疫原性等の観
点から別の細胞へと変更
することも想定される。
しかし、翻訳後修飾等が
大きく変わる可能性があ
り、これらの点も踏まえ
11/23
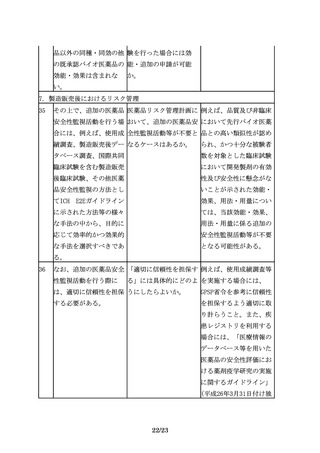
性評価にあたっては、比
較する先行バイオ医薬品
の品質特性の変動に留意
する必要がある。開発途
中で先行バイオ医薬品の
製法が変更されることも
あるが、製法の変更前の
ものを先行バイオ医薬品
として、バイオ後続品を
開発、承認申請すること
は可能である。
3.3 バイオ後続品の製法開発及び品質管理戦略構築にあたっての留意事項
3.3 ①宿主細胞株
13
先行バイオ医薬品の宿主 指針では、「・・・、先 「同一宿主細胞」とは、
細胞が明らかにされてい 行バイオ医薬品の宿主細 例えば、先行バイオ医薬
る場合は、同一宿主細胞 胞が明らかにされている 品がCHO細胞で製造され
を用いた開発を進めるこ 場合は同一宿主細胞を用 ている場合、CHO細胞の
とが望ましいが、安全性 いた開発を進めることが ことを指すが、CHO細胞
等の観点から、異なる宿 望ましい。」とあるが、 の中の亜種まで一致させ
主細胞(由来する生物種 「同一宿主細胞」とは、 ることができなくてもや
も含む起源の異なる細
例えば、どの程度の同一 むを得ないと考えられ
胞)が用いられる場合も 性が考えられるのか。ま る。一方で、先行バイオ
ある。
た、「望ましい」とした 医薬品がある細胞を用い
趣旨は何か。
ていることが明らかな場
合でも、免疫原性等の観
点から別の細胞へと変更
することも想定される。
しかし、翻訳後修飾等が
大きく変わる可能性があ
り、これらの点も踏まえ
11/23