よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
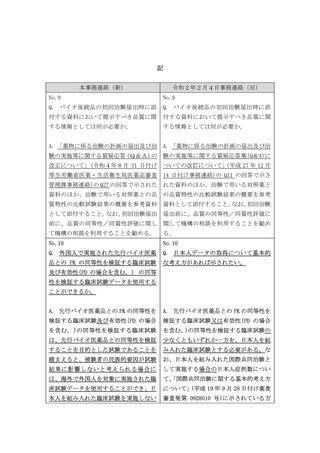
る。なお、欧米では、バ
イオ後続品と先行バイオ
医薬品の同等性/同質性
に関して、
biosimilarityという言
葉が用いられることがあ
る。
4
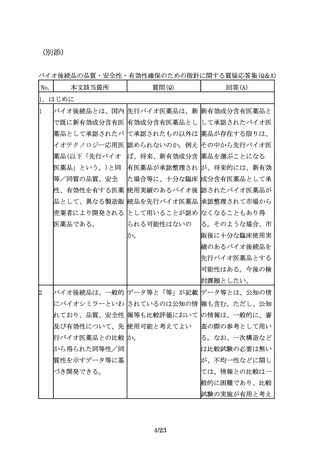
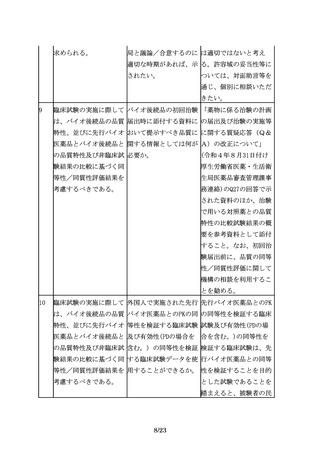
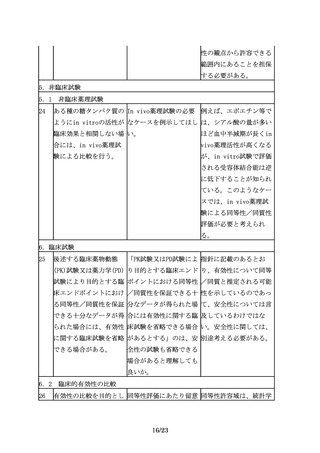
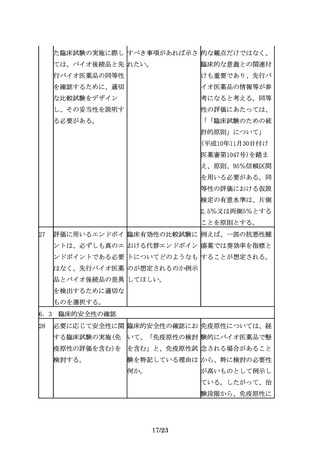
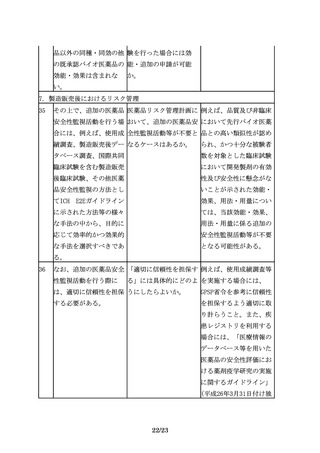
バイオ後続品の申請は、 バイオ後続品の承認申請 効能追加申請をする場
先行バイオ医薬品の再審 時点で、再審査期間が満 合、申請区分は「1―(7)
査期間の満了等をもって 了となっておらず申請対 バイオ後続品」となる。
可能となる。
象とならなかった効能に
ついて、再審査期間満了
後、効能追加申請をする
場合、申請区分は、「1
―(4)新効能医薬品」と
なるのか。
5
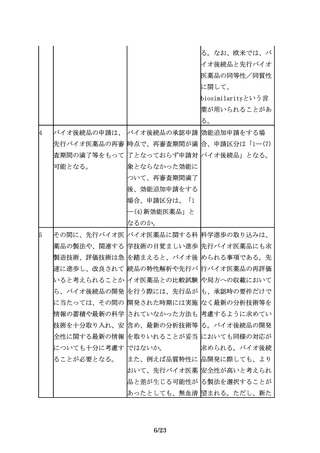
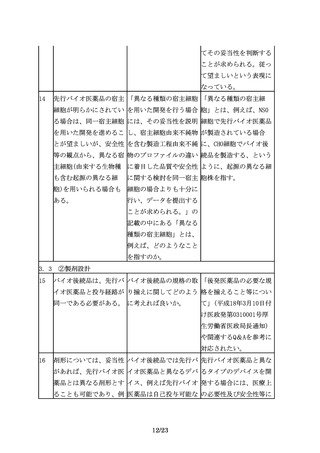
その間に、先行バイオ医 バイオ医薬品に関する科 科学進歩の取り込みは、
薬品の製法や、関連する 学技術の目覚ましい進歩 先行バイオ医薬品にも求
製造技術、評価技術は急 を踏まえると、バイオ後 められる事項である。先
速に進歩し、改良されて 続品の特性解析や先行バ 行バイオ医薬品の再評価
いると考えられることか イオ医薬品との比較試験 や局方への収載において
ら、バイオ後続品の開発 を行う際には、先行品が も、承認時の要件だけで
に当たっては、その間の 開発された時期には実施 なく最新の分析技術等を
情報の蓄積や最新の科学 されていなかった方法も 考慮するように求めてい
技術を十分取り入れ、安 含め、最新の分析技術等 る。バイオ後続品の開発
全性に関する最新の情報 を取りいれることが妥当 においても同様の対応が
についても十分に考慮す ではないか。
ることが必要となる。
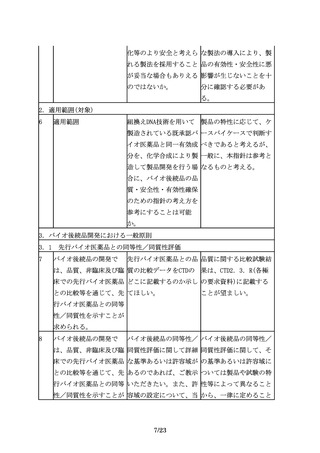
求められる。バイオ後続
また、例えば品質特性に 品開発に際しても、より
おいて、先行バイオ医薬 安全性が高いと考えられ
品と差が生じる可能性が る製法を選択することが
あったとしても、無血清 望まれる。ただし、新た
6/23
イオ後続品と先行バイオ
医薬品の同等性/同質性
に関して、
biosimilarityという言
葉が用いられることがあ
る。
4
バイオ後続品の申請は、 バイオ後続品の承認申請 効能追加申請をする場
先行バイオ医薬品の再審 時点で、再審査期間が満 合、申請区分は「1―(7)
査期間の満了等をもって 了となっておらず申請対 バイオ後続品」となる。
可能となる。
象とならなかった効能に
ついて、再審査期間満了
後、効能追加申請をする
場合、申請区分は、「1
―(4)新効能医薬品」と
なるのか。
5
その間に、先行バイオ医 バイオ医薬品に関する科 科学進歩の取り込みは、
薬品の製法や、関連する 学技術の目覚ましい進歩 先行バイオ医薬品にも求
製造技術、評価技術は急 を踏まえると、バイオ後 められる事項である。先
速に進歩し、改良されて 続品の特性解析や先行バ 行バイオ医薬品の再評価
いると考えられることか イオ医薬品との比較試験 や局方への収載において
ら、バイオ後続品の開発 を行う際には、先行品が も、承認時の要件だけで
に当たっては、その間の 開発された時期には実施 なく最新の分析技術等を
情報の蓄積や最新の科学 されていなかった方法も 考慮するように求めてい
技術を十分取り入れ、安 含め、最新の分析技術等 る。バイオ後続品の開発
全性に関する最新の情報 を取りいれることが妥当 においても同様の対応が
についても十分に考慮す ではないか。
ることが必要となる。
求められる。バイオ後続
また、例えば品質特性に 品開発に際しても、より
おいて、先行バイオ医薬 安全性が高いと考えられ
品と差が生じる可能性が る製法を選択することが
あったとしても、無血清 望まれる。ただし、新た
6/23