よむ、つかう、まなぶ。
【参考資料8】バイオ後続品の品質・安全性・有効性確保のための指針に関する(令和6年1月25日事務連絡) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
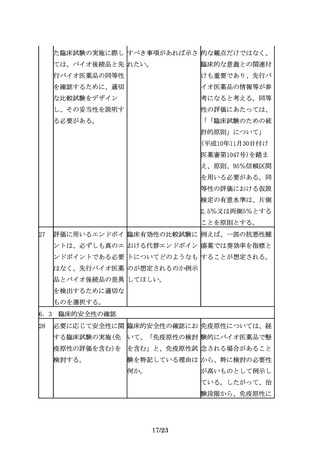
求められる。
局と議論/合意するのに は適切ではないと考え
適切な時期があれば、示 る。許容域の妥当性等に
されたい。
ついては、対面助言等を
通じ、個別に相談いただ
きたい。
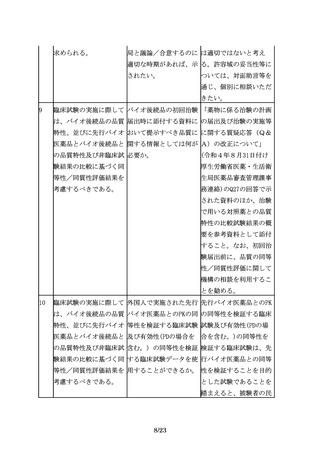
9
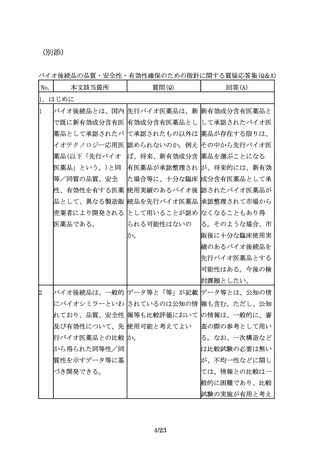
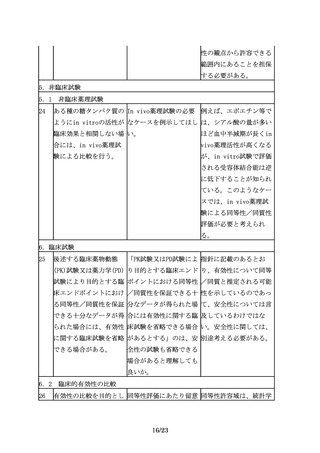
臨床試験の実施に際して バイオ後続品の初回治験 「薬物に係る治験の計画
は、バイオ後続品の品質 届出時に添付する資料に の届出及び治験の実施等
特性、並びに先行バイオ おいて提示すべき品質に に関する質疑応答(Q&
医薬品とバイオ後続品と 関する情報としては何が A)の改正について」
の品質特性及び非臨床試 必要か。
(令和4年8月31日付け
験結果の比較に基づく同
厚生労働省医薬・生活衛
等性/同質性評価結果を
生局医薬品審査管理課事
考慮するべきである。
務連絡)のQ27の回答で示
された資料のほか、治験
で用いる対照薬との品質
特性の比較試験結果の概
要を参考資料として添付
すること。なお、初回治
験届出前に、品質の同等
性/同質性評価に関して
機構の相談を利用するこ
とを勧める。
10
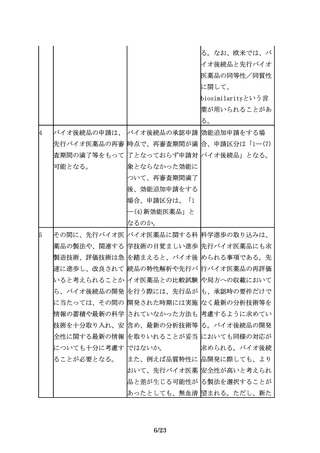
臨床試験の実施に際して 外国人で実施された先行 先行バイオ医薬品とのPK
は、バイオ後続品の品質 バイオ医薬品とのPKの同 の同等性を検証する臨床
特性、並びに先行バイオ 等性を検証する臨床試験 試験及び有効性(PDの場
医薬品とバイオ後続品と 及び有効性(PDの場合を 合を含む。)の同等性を
の品質特性及び非臨床試 含む。) の同等性を検証 検証する臨床試験は、先
験結果の比較に基づく同 する臨床試験データを使 行バイオ医薬品との同等
等性/同質性評価結果を 用することができるか。 性を検証することを目的
考慮するべきである。
とした試験であることを
踏まえると、被験者の民
8/23
局と議論/合意するのに は適切ではないと考え
適切な時期があれば、示 る。許容域の妥当性等に
されたい。
ついては、対面助言等を
通じ、個別に相談いただ
きたい。
9
臨床試験の実施に際して バイオ後続品の初回治験 「薬物に係る治験の計画
は、バイオ後続品の品質 届出時に添付する資料に の届出及び治験の実施等
特性、並びに先行バイオ おいて提示すべき品質に に関する質疑応答(Q&
医薬品とバイオ後続品と 関する情報としては何が A)の改正について」
の品質特性及び非臨床試 必要か。
(令和4年8月31日付け
験結果の比較に基づく同
厚生労働省医薬・生活衛
等性/同質性評価結果を
生局医薬品審査管理課事
考慮するべきである。
務連絡)のQ27の回答で示
された資料のほか、治験
で用いる対照薬との品質
特性の比較試験結果の概
要を参考資料として添付
すること。なお、初回治
験届出前に、品質の同等
性/同質性評価に関して
機構の相談を利用するこ
とを勧める。
10
臨床試験の実施に際して 外国人で実施された先行 先行バイオ医薬品とのPK
は、バイオ後続品の品質 バイオ医薬品とのPKの同 の同等性を検証する臨床
特性、並びに先行バイオ 等性を検証する臨床試験 試験及び有効性(PDの場
医薬品とバイオ後続品と 及び有効性(PDの場合を 合を含む。)の同等性を
の品質特性及び非臨床試 含む。) の同等性を検証 検証する臨床試験は、先
験結果の比較に基づく同 する臨床試験データを使 行バイオ医薬品との同等
等性/同質性評価結果を 用することができるか。 性を検証することを目的
考慮するべきである。
とした試験であることを
踏まえると、被験者の民
8/23