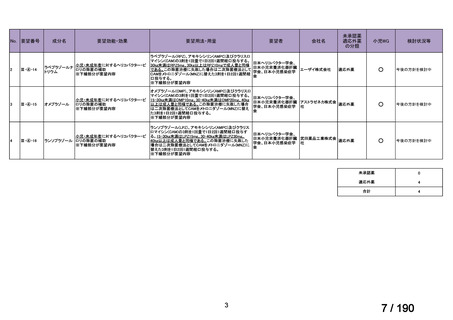
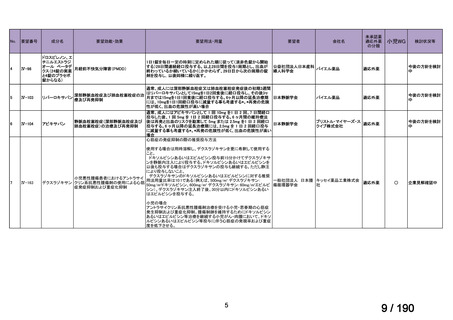
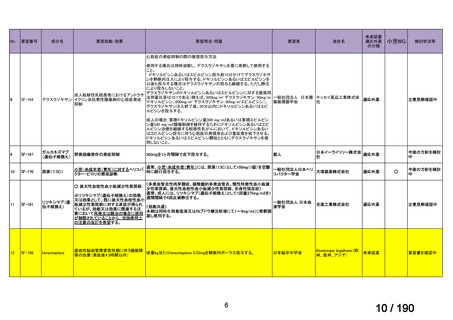
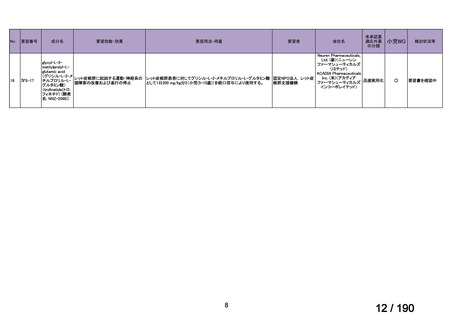
会議資料 (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00035.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第61回 1/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ウ
〔特記事項〕
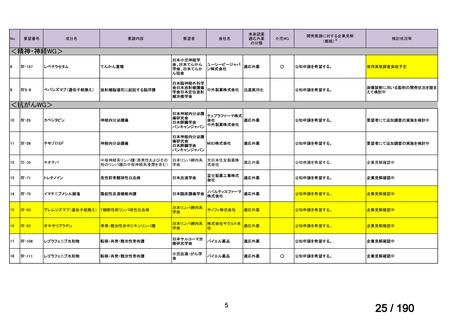
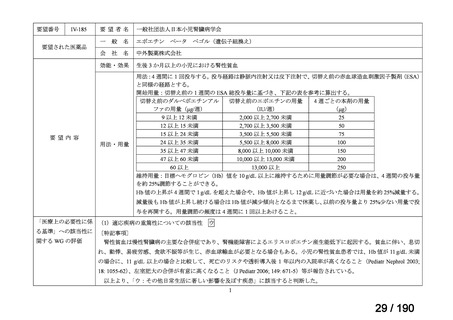
エポエチン ベータ ペゴル(遺伝子組換え)
(以下、
「本剤」)は、持続型の赤血球造血刺激因子(以下、
「ESA」)製剤であり、
米国、英国、独国及び仏国で、小児の腎性貧血患者において、他の ESA 製剤から本剤に切り替える場合の用法・用量が承認され
ている。国内外の診療ガイドラインでは、本剤を含む ESA 製剤は成人の腎性貧血に対する標準的治療法に位置づけられており、
小児に対しても成人に準じた治療が推奨されていることから、
「ウ:欧米等において標準的療法に位置づけられており、国内外の
医療環境の違い等を踏まえても国内における有用性が期待できると考えられる」に該当すると判断した。
備
考
要望者が実施予定の国内使用実態調査の結果を踏まえ、今後の開発方針を検討する必要があると考える。
2
30 / 190