よむ、つかう、まなぶ。
資料4-1 医薬品等の使用上の注意の改訂について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
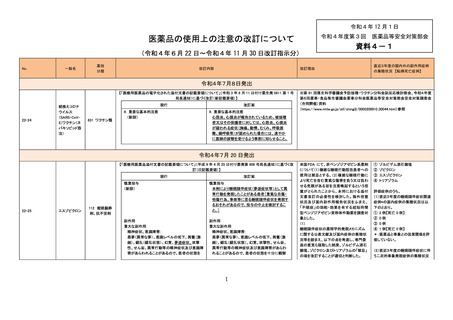
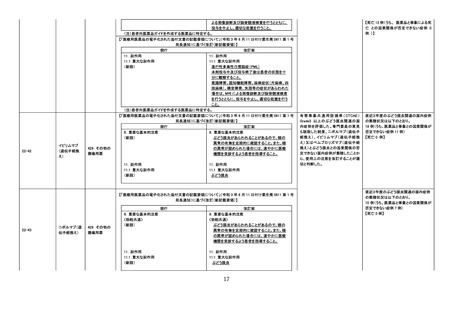
令和4年 12 月1日
令和4年度第3回 医薬品等安全対策部会
医薬品の使用上の注意の改訂について
(令和4年6月 22 日~令和4年 11 月 30 日改訂指示分)
No.
一般名
薬効
分類
改訂内容
資料4-1
改訂理由
直近3年度の国内外の副作用症例
の集積状況 【転帰死亡症例】
令和4年7月8日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号
局長通知)に基づく改訂(新記載要領)】
22-24
組換えコロナ
ウイルス
(SARS-CoV2)ワクチン(ヌ
バキソビッド筋
注)
現行
631 ワクチン類
改訂案
8. 重要な基本的注意
(新設)
8. 重要な基本的注意
心筋炎、心膜炎が報告されているため、被接種
者又はその保護者に対しては、心筋炎、心膜炎
が疑われる症状(胸痛、動悸、むくみ、呼吸困
難、頻呼吸等)が認められた場合には、速やか
に医師の診察を受けるよう事前に知らせること。
※第 81 回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度
第6回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
(合同開催)資料
(https://www.mhlw.go.jp/stf/shingi2/0000208910_00044.html)参照
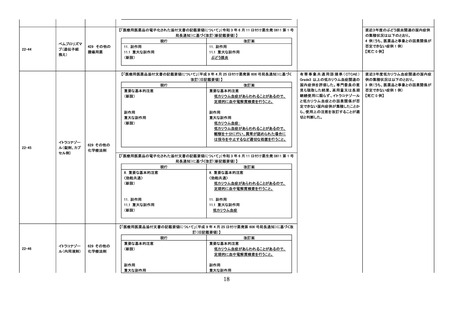
令和4年7月 20 日発出
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改
訂(旧記載要領)】
現行
22-25
エスゾピクロン
改訂案
慎重投与
(新設)
慎重投与
本剤により睡眠随伴症状(夢遊症状等)として異
常行動を発現したことがある患者[重篤な自傷・
他傷行為、事故等に至る睡眠随伴症状を発現す
るおそれがあるので、投与の中止を検討するこ
と。]
副作用
重大な副作用
精神症状、意識障害:
悪夢(異常な夢)、意識レベルの低下、興奮(激
越)、錯乱(錯乱状態)、幻覚、夢遊症状、攻撃
性、せん妄、異常行動等の精神症状及び意識障
害があらわれることがあるので、患者の状態を
副作用
重大な副作用
精神症状、意識障害:
悪夢(異常な夢)、意識レベルの低下、興奮(激
越)、錯乱(錯乱状態)、幻覚、攻撃性、せん妄、
異常行動等の精神症状及び意識障害があらわ
れることがあるので、患者の状態を十分に観察
112 催眠鎮静
剤、抗不安剤
1
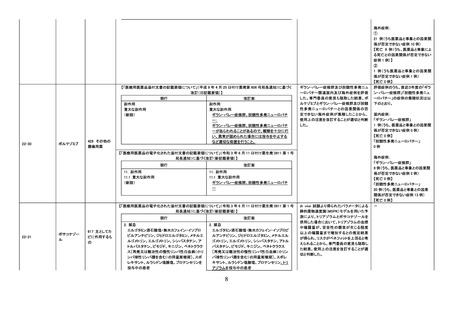
米国 FDA にて、非ベンゾジアゼピン系薬剤
について(1)複雑な睡眠行動既往患者への
使用は禁忌とする、(2)複雑な睡眠行動に
より死亡を含む重篤な傷害を負う又は負わ
せる危険がある旨を注意喚起するという措
置がとられたことから、本邦における添付
文書改訂の必要性を検討した。海外措置
状況及び国内副作用報告状況をふまえ、
「不眠症」の効能・効果を有する超短時間
型ベンゾジアゼピン受容体作動薬を調査対
象とした。
(1)
睡眠随伴症状の薬理学的発現メカニズム
に関する公表文献及び国内症例の集積状
況等を踏まえ、以下の点を考慮し、専門委
員の意見も聴取した結果、ゾルピデム酒石
酸塩、ゾピクロン及びトリアゾラムの「禁忌」
の項を改訂することが適切と判断した。
①
②
③
④
ゾルピデム酒石酸塩
ゾピクロン
エスゾピクロン
トリアゾラム
評価症例のうち、
(1)直近3年度の睡眠随伴症状関連
症例*の国内症例の集積状況は以
下のとおり。
① 2 例【死亡 0 例】
② 0例
③ 0例
④ 1 例【死亡 0 例】
*:医薬品と事象との因果関係を評
価していない。
(2)直近3年度の睡眠随伴症状に伴
う二次的事象発現症例の集積状況
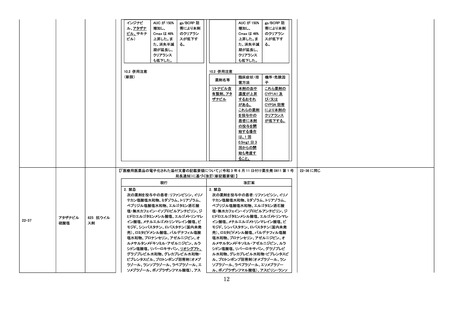
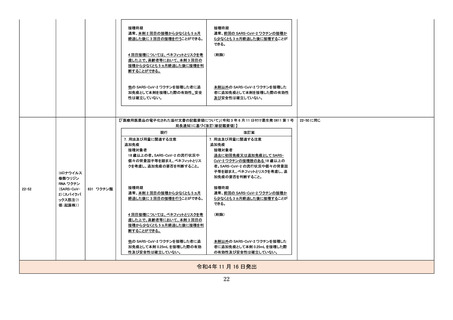
令和4年度第3回 医薬品等安全対策部会
医薬品の使用上の注意の改訂について
(令和4年6月 22 日~令和4年 11 月 30 日改訂指示分)
No.
一般名
薬効
分類
改訂内容
資料4-1
改訂理由
直近3年度の国内外の副作用症例
の集積状況 【転帰死亡症例】
令和4年7月8日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号
局長通知)に基づく改訂(新記載要領)】
22-24
組換えコロナ
ウイルス
(SARS-CoV2)ワクチン(ヌ
バキソビッド筋
注)
現行
631 ワクチン類
改訂案
8. 重要な基本的注意
(新設)
8. 重要な基本的注意
心筋炎、心膜炎が報告されているため、被接種
者又はその保護者に対しては、心筋炎、心膜炎
が疑われる症状(胸痛、動悸、むくみ、呼吸困
難、頻呼吸等)が認められた場合には、速やか
に医師の診察を受けるよう事前に知らせること。
※第 81 回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度
第6回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
(合同開催)資料
(https://www.mhlw.go.jp/stf/shingi2/0000208910_00044.html)参照
令和4年7月 20 日発出
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改
訂(旧記載要領)】
現行
22-25
エスゾピクロン
改訂案
慎重投与
(新設)
慎重投与
本剤により睡眠随伴症状(夢遊症状等)として異
常行動を発現したことがある患者[重篤な自傷・
他傷行為、事故等に至る睡眠随伴症状を発現す
るおそれがあるので、投与の中止を検討するこ
と。]
副作用
重大な副作用
精神症状、意識障害:
悪夢(異常な夢)、意識レベルの低下、興奮(激
越)、錯乱(錯乱状態)、幻覚、夢遊症状、攻撃
性、せん妄、異常行動等の精神症状及び意識障
害があらわれることがあるので、患者の状態を
副作用
重大な副作用
精神症状、意識障害:
悪夢(異常な夢)、意識レベルの低下、興奮(激
越)、錯乱(錯乱状態)、幻覚、攻撃性、せん妄、
異常行動等の精神症状及び意識障害があらわ
れることがあるので、患者の状態を十分に観察
112 催眠鎮静
剤、抗不安剤
1
米国 FDA にて、非ベンゾジアゼピン系薬剤
について(1)複雑な睡眠行動既往患者への
使用は禁忌とする、(2)複雑な睡眠行動に
より死亡を含む重篤な傷害を負う又は負わ
せる危険がある旨を注意喚起するという措
置がとられたことから、本邦における添付
文書改訂の必要性を検討した。海外措置
状況及び国内副作用報告状況をふまえ、
「不眠症」の効能・効果を有する超短時間
型ベンゾジアゼピン受容体作動薬を調査対
象とした。
(1)
睡眠随伴症状の薬理学的発現メカニズム
に関する公表文献及び国内症例の集積状
況等を踏まえ、以下の点を考慮し、専門委
員の意見も聴取した結果、ゾルピデム酒石
酸塩、ゾピクロン及びトリアゾラムの「禁忌」
の項を改訂することが適切と判断した。
①
②
③
④
ゾルピデム酒石酸塩
ゾピクロン
エスゾピクロン
トリアゾラム
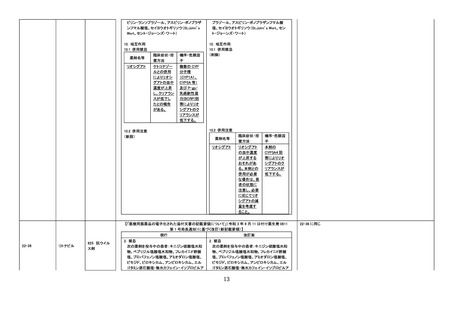
評価症例のうち、
(1)直近3年度の睡眠随伴症状関連
症例*の国内症例の集積状況は以
下のとおり。
① 2 例【死亡 0 例】
② 0例
③ 0例
④ 1 例【死亡 0 例】
*:医薬品と事象との因果関係を評
価していない。
(2)直近3年度の睡眠随伴症状に伴
う二次的事象発現症例の集積状況