よむ、つかう、まなぶ。
資料4-1 医薬品等の使用上の注意の改訂について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
Kane,S.P.,et al.:Perfusion 2018;33:320-322
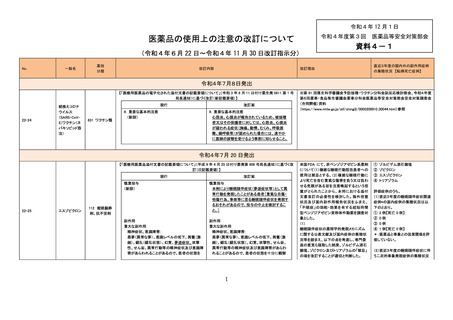
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号
局長通知)に基づく改訂(新記載要領)】
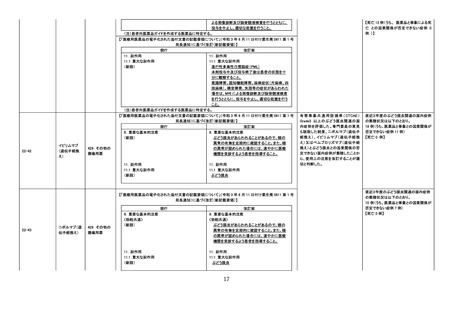
現行
22-56
ロキサデュスタ
ット
399 他に分類さ
れない代謝性
医薬品
改訂案
8. 重要な基本的注意
(新設)
8. 重要な基本的注意
本剤投与中に中枢性甲状腺機能低下症があら
われることがあり、投与開始後約 2 週間であら
われたとの報告もある。本剤投与中は定期的に
甲状腺機能検査(TSH、遊離 T3、遊離 T4)を行
うなど、患者の状態を十分に観察すること。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
中枢性甲状腺機能低下症
血中甲状腺刺激ホルモン(TSH)が正常範囲内
又は低値を示す中枢性甲状腺機能低下症があ
らわれることがある。症状や徴候があらわれた場
合には、必要に応じて投与の中止、甲状腺ホル
モン製剤の投与などの適切な処置を行うこと。
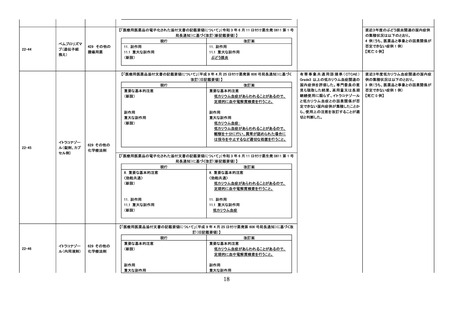
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく
改訂(旧記載要領)】
現行
副作用
重大な副作用
(新設)
22-57
イマチニブメシ
ル酸塩
改訂案
副作用
重大な副作用
血栓性微小血管症:
血栓性微小血管症があらわれることがあるの
で、破砕赤血球を伴う貧血、血小板減少、腎機
能障害等が認められた場合には、投与を中止
し、適切な処置を行うこと。
429 その他の
腫瘍用薬
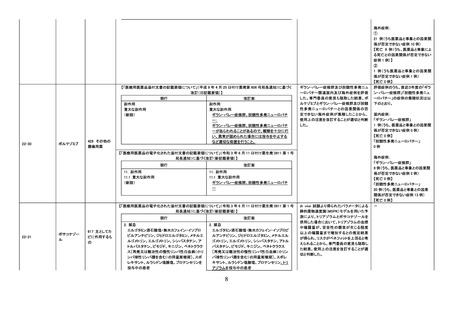
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号
局長通知)に基づく改訂(新記載要領)】
現行
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
血栓性微小血管症
破砕赤血球を伴う貧血、血小板減少、腎機能障
害等が認められた場合には、投与を中止し、適
切な処置を行うこと。
25
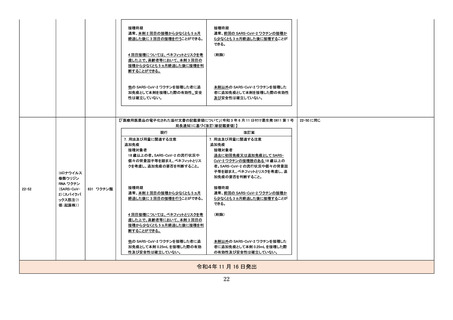
甲状腺機能低下症関連の国内症例を評価
した。専門委員の意見も聴取した結果、本
剤と中枢性甲状腺機能低下症との因果関
係の否定できない国内症例が集積したこと
から、使用上の注意を改訂することが適切
と判断した。
評価症例のうち、直近3年度の未知
の甲状腺機能低下症関連の国内症
例*の集積状況は以下のとおり。
・国内 29 例(うち、医薬品と事象との
因果関係が否定できない症例 9 例
(いずれも中枢性甲状腺機能低下
症))
【死亡 0 例】
(販売開始年月:2019 年 11 月)
*:TSH 値、遊離 T4 値があり、関連
する臨床所見の記載がある症例(甲
状腺疾患診断ガイドライン 2021 参
考)のうち、有害事象共通用語規準
CTCAE v5.0 甲 状 腺 機 能 低 下 症
Grade3 相当に至ったと考えられる
症例
血栓性微小血管症関連の国内及び海外症
例を評価した。専門委員の意見も聴取した
結果、イマチニブメシル酸塩と血栓性微小
血管症との因果関係の否定できない国内
及び海外症例が集積したことから、使用上
の注意を改訂することが適切と判断した。
評価症例のうち、直近3年度の血栓
性微小血管症関連症例の集積状況
は以下のとおり。
・国内 0 例
・海外 4 例(うち、医薬品と事象との
因果関係が否定できない症例 1 例)
【死亡 0 例】
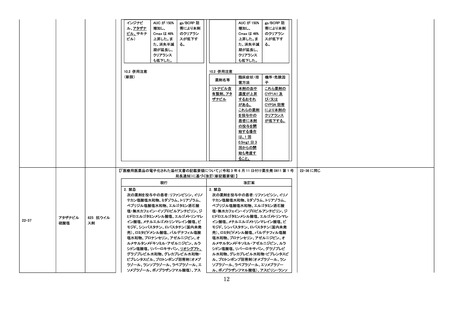
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号
局長通知)に基づく改訂(新記載要領)】
現行
22-56
ロキサデュスタ
ット
399 他に分類さ
れない代謝性
医薬品
改訂案
8. 重要な基本的注意
(新設)
8. 重要な基本的注意
本剤投与中に中枢性甲状腺機能低下症があら
われることがあり、投与開始後約 2 週間であら
われたとの報告もある。本剤投与中は定期的に
甲状腺機能検査(TSH、遊離 T3、遊離 T4)を行
うなど、患者の状態を十分に観察すること。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
中枢性甲状腺機能低下症
血中甲状腺刺激ホルモン(TSH)が正常範囲内
又は低値を示す中枢性甲状腺機能低下症があ
らわれることがある。症状や徴候があらわれた場
合には、必要に応じて投与の中止、甲状腺ホル
モン製剤の投与などの適切な処置を行うこと。
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく
改訂(旧記載要領)】
現行
副作用
重大な副作用
(新設)
22-57
イマチニブメシ
ル酸塩
改訂案
副作用
重大な副作用
血栓性微小血管症:
血栓性微小血管症があらわれることがあるの
で、破砕赤血球を伴う貧血、血小板減少、腎機
能障害等が認められた場合には、投与を中止
し、適切な処置を行うこと。
429 その他の
腫瘍用薬
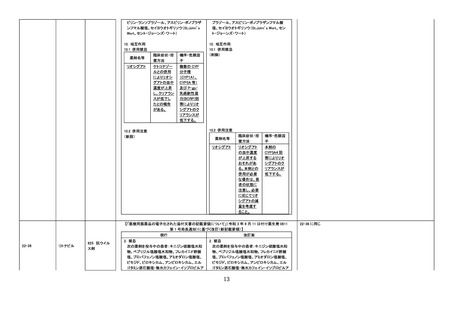
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号
局長通知)に基づく改訂(新記載要領)】
現行
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
血栓性微小血管症
破砕赤血球を伴う貧血、血小板減少、腎機能障
害等が認められた場合には、投与を中止し、適
切な処置を行うこと。
25
甲状腺機能低下症関連の国内症例を評価
した。専門委員の意見も聴取した結果、本
剤と中枢性甲状腺機能低下症との因果関
係の否定できない国内症例が集積したこと
から、使用上の注意を改訂することが適切
と判断した。
評価症例のうち、直近3年度の未知
の甲状腺機能低下症関連の国内症
例*の集積状況は以下のとおり。
・国内 29 例(うち、医薬品と事象との
因果関係が否定できない症例 9 例
(いずれも中枢性甲状腺機能低下
症))
【死亡 0 例】
(販売開始年月:2019 年 11 月)
*:TSH 値、遊離 T4 値があり、関連
する臨床所見の記載がある症例(甲
状腺疾患診断ガイドライン 2021 参
考)のうち、有害事象共通用語規準
CTCAE v5.0 甲 状 腺 機 能 低 下 症
Grade3 相当に至ったと考えられる
症例
血栓性微小血管症関連の国内及び海外症
例を評価した。専門委員の意見も聴取した
結果、イマチニブメシル酸塩と血栓性微小
血管症との因果関係の否定できない国内
及び海外症例が集積したことから、使用上
の注意を改訂することが適切と判断した。
評価症例のうち、直近3年度の血栓
性微小血管症関連症例の集積状況
は以下のとおり。
・国内 0 例
・海外 4 例(うち、医薬品と事象との
因果関係が否定できない症例 1 例)
【死亡 0 例】