よむ、つかう、まなぶ。
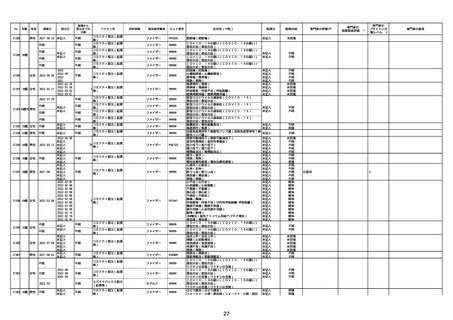
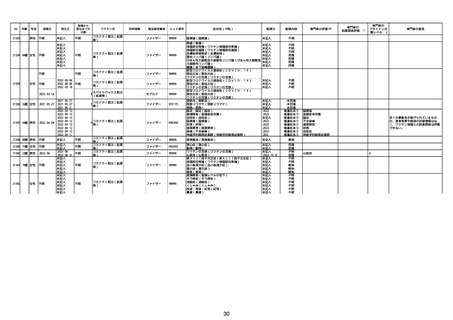
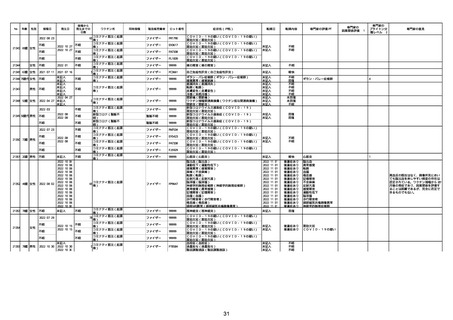
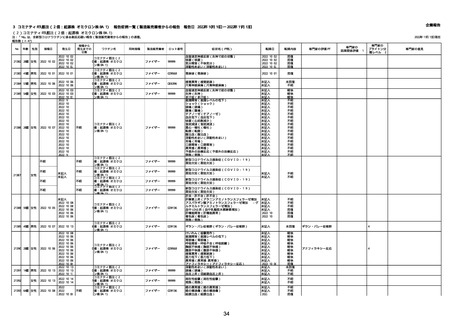
資料1-2-2-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における報告症例一覧) (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
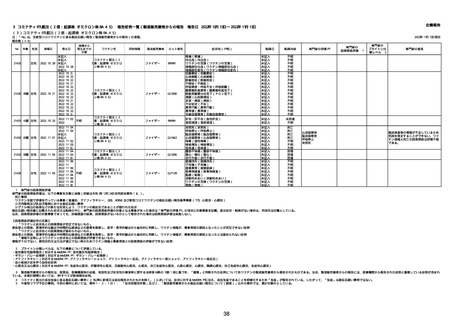
$
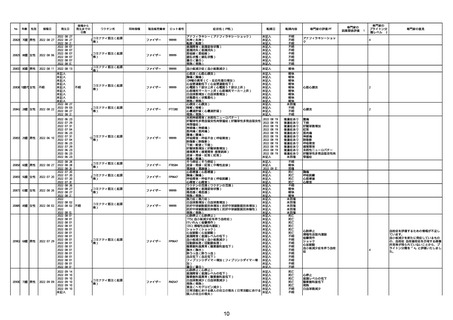
No
年齢
性別
接種日
発生日
$
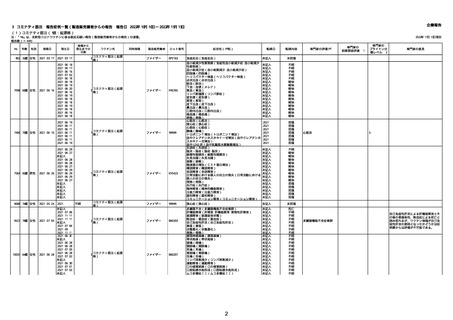
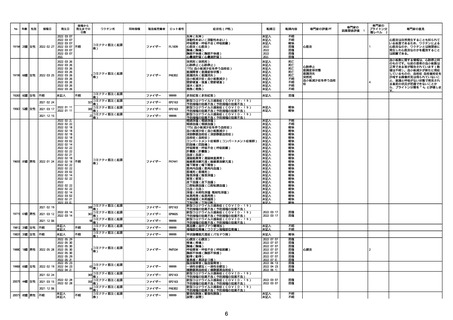
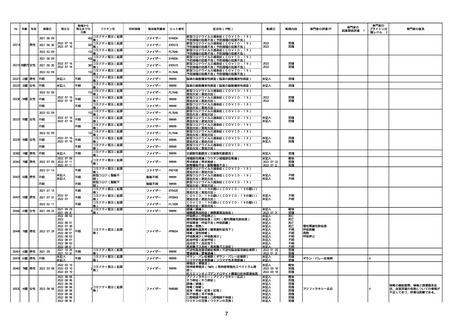
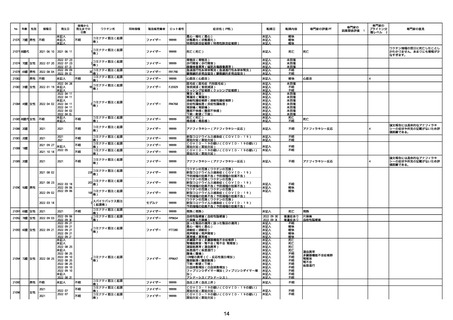
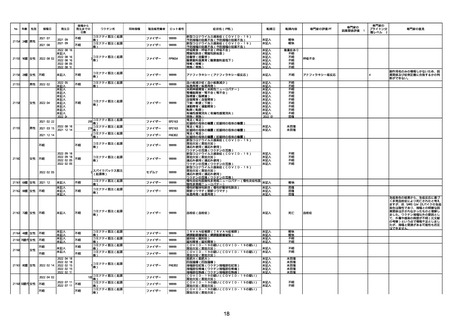
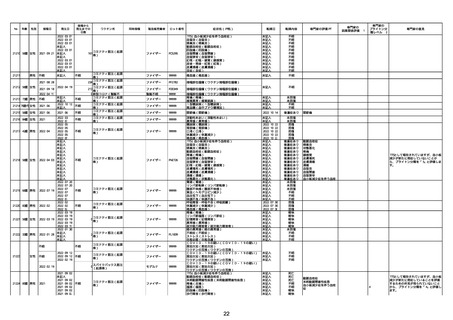
21426 13歳 男性
21427
2022/10/25
男性
2022/10/31
21428 70歳 男性
2022/09/27
接種から
発生までの
日数
コミナティ筋注(2
1 価:起源株/オミクロ
ン株BA.1)
2022/10/26
2022
2022
2022
2022
2022/09/27
2022/10/16
2022/10/16
2022/10/16
ワクチン名
不明
同時接種
製造販売業者
ファイザー
症状名(PT名)
ロット番号
GD9136
コミナティ筋注(2
価:起源株/オミクロ
ン株BA.1)
ファイザー
99999
コミナティ筋注(2
0 価:起源株/オミクロ
ン株BA.1)
ファイザー
GD9568
転帰日
転帰内容
心筋炎(心筋炎)
未記入
軽快
リンパ節腫脹(リンパ節症)
倦怠感(倦怠感)
発熱(発熱)
末梢腫脹(末梢腫脹)
ワクチンの互換(ワクチンの互換)
外転神経麻痺(第6脳神経麻痺)
炎症(炎症)
微小血管症(微小血管症)
未記入
未記入
未記入
未記入
未記入
未記入
未記入
未記入
不明
不明
不明
不明
不明
軽快
軽快
軽快
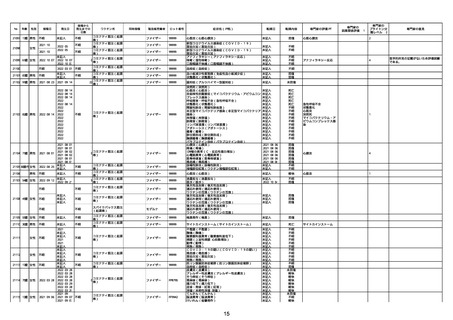
専門家の
因果関係評価※1
専門家の評価PT
専門家の
ブライトン分
類レベル※2
専門家の意見
心筋炎
γ
4
-
-
-
-
-
-
-
-
※1 専門家の因果関係評価
専門家の因果関係評価は、以下の事象を対象に実施(詳細は令和3年12月24日合同部会資料1-8。)。
①死亡事例
②ワクチン全般で評価を行っている事象(後遺症、アナフィラキシー、GBS、ADEM)及び新型コロナワクチンの副反応疑い報告基準事象(TTS、心筋炎・心膜炎)
③小児用製剤及び乳幼児製剤における副反応疑い事例
④シグナル検出の結果などの新たな知見により、ワクチンの副反応であることが疑われた症状
副反応疑い報告書に記載された症状又は転帰の中に、専門家の因果関係評価の対象となる事象があった場合は「専門家の評価PT」の項目に対象事象を記載。該当症状・転帰がない場合は、同項目は空欄としている。
なお、因果関係評価の対象事象であっても、詳細調査の結果、因果関係がないものとして報告された場合は因果関係評価は実施しない。
【因果関係評価記号の定義】
α:「ワクチンと症状名との因果関係が否定できないもの」
原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、ワクチン接種が、事象発現の原因となったことが否定できない症例
β:「ワクチンと症状名との因果関係が認められないもの」
原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、ワクチン接種が、事象発現の原因となったとは認められない症例
γ:「情報不足等によりワクチンと症状名との因果関係が評価できないもの」
情報が十分でない、使用目的又は方法が適正でない等のためワクチン接種と事象発現との因果関係の評価ができない症例
※2 ブライトン分類レベルは、以下の事象について評価している。
・急性散在性脳脊髄炎(対応するMedDRA PT:急性散在性脳脊髄炎)
・ギラン・バレー症候群(対応するMedDRA PT:ギラン・バレー症候群)
・アナフィラキシー(対応するMedDRA PT:アナフィラキシーショック、アナフィラキシー反応、アナフィラキシー様ショック、アナフィラキシー様反応)
・血小板減少症を伴う血栓症症例
・心筋炎又は心膜炎(対応するMedDRA PT:免疫性心筋炎、好酸球性心筋炎、巨細胞性心筋炎、心筋炎、自己免疫性心筋炎、心筋心膜炎、心膜炎、胸膜心膜炎、自己免疫性心膜炎、免疫性心膜炎)
※3 製造販売業者からの報告は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第68条の10第1項に基づき、「重篤」と判断された症例について各ワクチンの製造販売業者から報告されたものである。なお、製造販売業者からの報告には、医療機関から報告された症例と重複している症例が含まれ
ている。本集計期間においては、〜No.21382が追加報告症例、No.21383〜が新規報告症例。
※4 コミナティ筋注の追加免疫に係る副反応疑い事例(2/1以降に新規又は追加報告されたものを除く。)においては、症状に対するMedDRA PTに加え、追加免疫であることを明確化するため「免疫」が報告されている。したがって、「免疫」は副反応疑い事例ではない。
※5 今後取り下げ予定の事例。今回の資料においては、資料1−2−1の1.⑤「症状別報告件数」及び2.「製造販売業者からの副反応疑い報告について(図表)」以外の資料では、集計対象外としている。
37
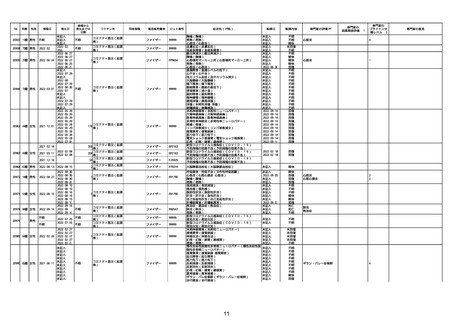
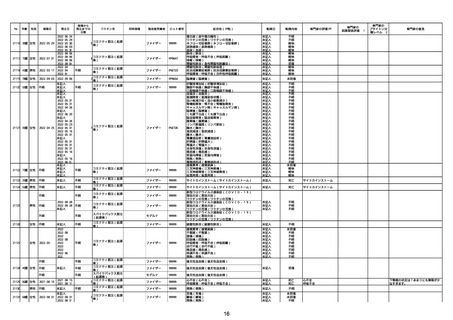
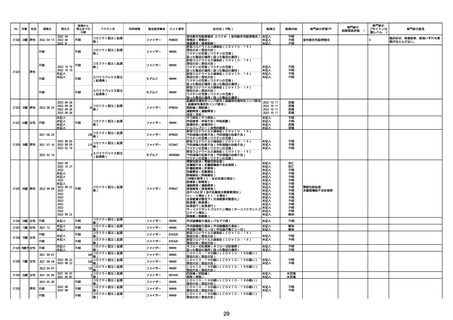
No
年齢
性別
接種日
発生日
$
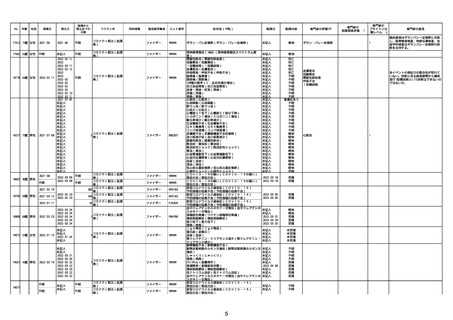
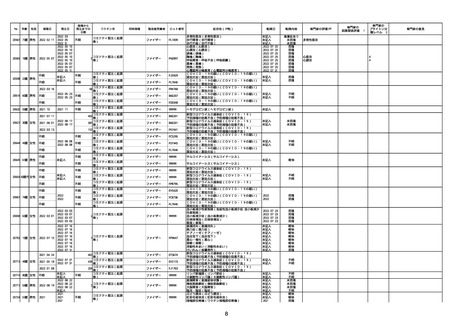
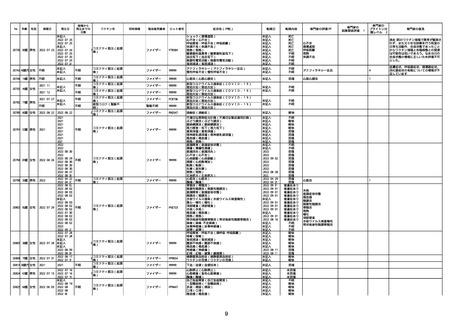
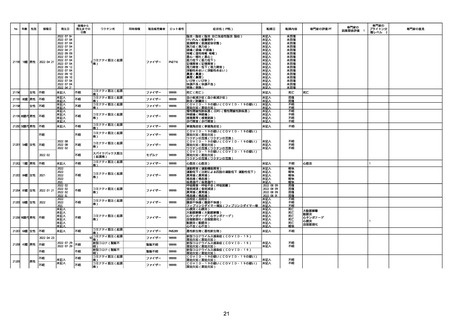
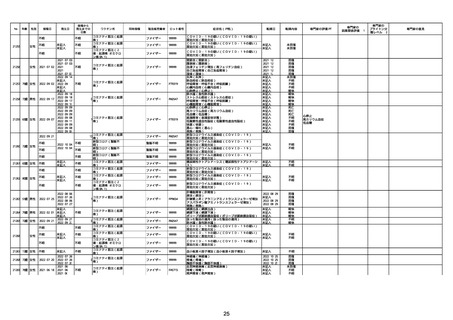
21426 13歳 男性
21427
2022/10/25
男性
2022/10/31
21428 70歳 男性
2022/09/27
接種から
発生までの
日数
コミナティ筋注(2
1 価:起源株/オミクロ
ン株BA.1)
2022/10/26
2022
2022
2022
2022
2022/09/27
2022/10/16
2022/10/16
2022/10/16
ワクチン名
不明
同時接種
製造販売業者
ファイザー
症状名(PT名)
ロット番号
GD9136
コミナティ筋注(2
価:起源株/オミクロ
ン株BA.1)
ファイザー
99999
コミナティ筋注(2
0 価:起源株/オミクロ
ン株BA.1)
ファイザー
GD9568
転帰日
転帰内容
心筋炎(心筋炎)
未記入
軽快
リンパ節腫脹(リンパ節症)
倦怠感(倦怠感)
発熱(発熱)
末梢腫脹(末梢腫脹)
ワクチンの互換(ワクチンの互換)
外転神経麻痺(第6脳神経麻痺)
炎症(炎症)
微小血管症(微小血管症)
未記入
未記入
未記入
未記入
未記入
未記入
未記入
未記入
不明
不明
不明
不明
不明
軽快
軽快
軽快
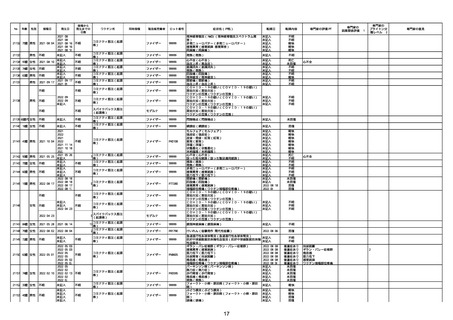
専門家の
因果関係評価※1
専門家の評価PT
専門家の
ブライトン分
類レベル※2
専門家の意見
心筋炎
γ
4
-
-
-
-
-
-
-
-
※1 専門家の因果関係評価
専門家の因果関係評価は、以下の事象を対象に実施(詳細は令和3年12月24日合同部会資料1-8。)。
①死亡事例
②ワクチン全般で評価を行っている事象(後遺症、アナフィラキシー、GBS、ADEM)及び新型コロナワクチンの副反応疑い報告基準事象(TTS、心筋炎・心膜炎)
③小児用製剤及び乳幼児製剤における副反応疑い事例
④シグナル検出の結果などの新たな知見により、ワクチンの副反応であることが疑われた症状
副反応疑い報告書に記載された症状又は転帰の中に、専門家の因果関係評価の対象となる事象があった場合は「専門家の評価PT」の項目に対象事象を記載。該当症状・転帰がない場合は、同項目は空欄としている。
なお、因果関係評価の対象事象であっても、詳細調査の結果、因果関係がないものとして報告された場合は因果関係評価は実施しない。
【因果関係評価記号の定義】
α:「ワクチンと症状名との因果関係が否定できないもの」
原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、ワクチン接種が、事象発現の原因となったことが否定できない症例
β:「ワクチンと症状名との因果関係が認められないもの」
原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、ワクチン接種が、事象発現の原因となったとは認められない症例
γ:「情報不足等によりワクチンと症状名との因果関係が評価できないもの」
情報が十分でない、使用目的又は方法が適正でない等のためワクチン接種と事象発現との因果関係の評価ができない症例
※2 ブライトン分類レベルは、以下の事象について評価している。
・急性散在性脳脊髄炎(対応するMedDRA PT:急性散在性脳脊髄炎)
・ギラン・バレー症候群(対応するMedDRA PT:ギラン・バレー症候群)
・アナフィラキシー(対応するMedDRA PT:アナフィラキシーショック、アナフィラキシー反応、アナフィラキシー様ショック、アナフィラキシー様反応)
・血小板減少症を伴う血栓症症例
・心筋炎又は心膜炎(対応するMedDRA PT:免疫性心筋炎、好酸球性心筋炎、巨細胞性心筋炎、心筋炎、自己免疫性心筋炎、心筋心膜炎、心膜炎、胸膜心膜炎、自己免疫性心膜炎、免疫性心膜炎)
※3 製造販売業者からの報告は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第68条の10第1項に基づき、「重篤」と判断された症例について各ワクチンの製造販売業者から報告されたものである。なお、製造販売業者からの報告には、医療機関から報告された症例と重複している症例が含まれ
ている。本集計期間においては、〜No.21382が追加報告症例、No.21383〜が新規報告症例。
※4 コミナティ筋注の追加免疫に係る副反応疑い事例(2/1以降に新規又は追加報告されたものを除く。)においては、症状に対するMedDRA PTに加え、追加免疫であることを明確化するため「免疫」が報告されている。したがって、「免疫」は副反応疑い事例ではない。
※5 今後取り下げ予定の事例。今回の資料においては、資料1−2−1の1.⑤「症状別報告件数」及び2.「製造販売業者からの副反応疑い報告について(図表)」以外の資料では、集計対象外としている。
37