よむ、つかう、まなぶ。
総-2参考1○最適使用推進ガイドラインについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00190.html |
| 出典情報 | 中央社会保険医療協議会 総会(第546回 6/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
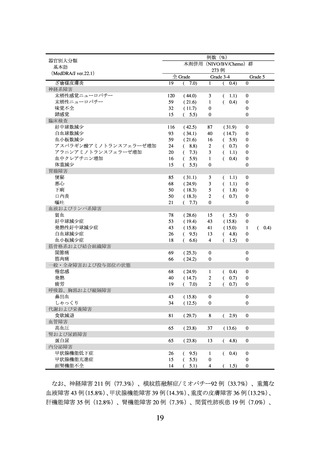
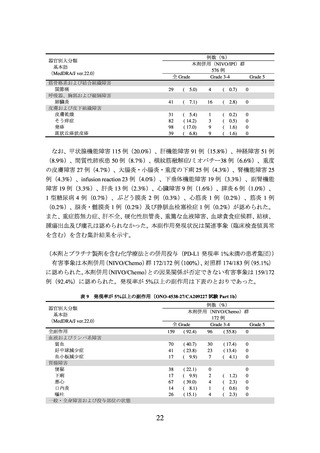
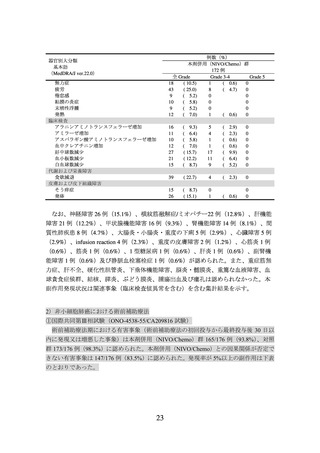
3.臨床成績
1)切除不能な進行・再発の非小細胞肺癌(扁平上皮癌及び非扁平上皮癌)、及び 2)
非小細胞肺癌における術前補助療法の承認時に評価を行った主な臨床試験の成績を示
す。
【有効性】
1)切除不能な進行・再発の非小細胞肺癌(扁平上皮癌及び非扁平上皮癌)
〈扁平上皮癌〉
① 国内第Ⅱ相試験(ONO-4538-05 試験)
プラチナ製剤を含む化学療法歴を有する切除不能なⅢB 期/Ⅳ期又は再発の扁平上皮
癌患者(ECOG Performance Status 0 及び 1)35 例を対象に、本剤 3 mg/kg を 2 週間間隔
で点滴静注した。主要評価項目である奏効率(RECIST ガイドライン 1.1 版に基づく中
央判定による CR 又は PR)は 25.7%(95%信頼区間:14.2~42.1%)であった。なお、事
前に設定した閾値は 9.0%であった。
② 海外第Ⅲ相試験(CA209017 試験)
(N Engl J Med 2015; 373: 123-35)
プラチナ製剤を含む化学療法歴を有する切除不能なⅢB 期/Ⅳ期又は再発の扁平上皮
癌患者(ECOG Performance Status 0 及び 1)272 例を対象に、ドセタキセルを対照とし
て本剤 3 mg/kg を 2 週間間隔で点滴静注した(本剤群 135 例、ドセタキセル群 137 例)
。
中間解析の結果、主要評価項目である全生存期間(以下、
「OS」という。)
(中央値[95%
信頼区間]
)は、本剤群で 9.23[7.33~13.27]カ月、ドセタキセル群で 6.01[5.13~7.33]
カ月であり、本剤はドセタキセルに対し統計学的に有意な延長を示した(ハザード比
0.59[96.85%信頼区間:0.43~0.81]
、p=0.0002(両側)
[層別 log-rank 検定、有意水準(両
側)0.0315])。
4
1)切除不能な進行・再発の非小細胞肺癌(扁平上皮癌及び非扁平上皮癌)、及び 2)
非小細胞肺癌における術前補助療法の承認時に評価を行った主な臨床試験の成績を示
す。
【有効性】
1)切除不能な進行・再発の非小細胞肺癌(扁平上皮癌及び非扁平上皮癌)
〈扁平上皮癌〉
① 国内第Ⅱ相試験(ONO-4538-05 試験)
プラチナ製剤を含む化学療法歴を有する切除不能なⅢB 期/Ⅳ期又は再発の扁平上皮
癌患者(ECOG Performance Status 0 及び 1)35 例を対象に、本剤 3 mg/kg を 2 週間間隔
で点滴静注した。主要評価項目である奏効率(RECIST ガイドライン 1.1 版に基づく中
央判定による CR 又は PR)は 25.7%(95%信頼区間:14.2~42.1%)であった。なお、事
前に設定した閾値は 9.0%であった。
② 海外第Ⅲ相試験(CA209017 試験)
(N Engl J Med 2015; 373: 123-35)
プラチナ製剤を含む化学療法歴を有する切除不能なⅢB 期/Ⅳ期又は再発の扁平上皮
癌患者(ECOG Performance Status 0 及び 1)272 例を対象に、ドセタキセルを対照とし
て本剤 3 mg/kg を 2 週間間隔で点滴静注した(本剤群 135 例、ドセタキセル群 137 例)
。
中間解析の結果、主要評価項目である全生存期間(以下、
「OS」という。)
(中央値[95%
信頼区間]
)は、本剤群で 9.23[7.33~13.27]カ月、ドセタキセル群で 6.01[5.13~7.33]
カ月であり、本剤はドセタキセルに対し統計学的に有意な延長を示した(ハザード比
0.59[96.85%信頼区間:0.43~0.81]
、p=0.0002(両側)
[層別 log-rank 検定、有意水準(両
側)0.0315])。
4