よむ、つかう、まなぶ。
【資料3】医薬局からの定期報告[992KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35321.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第13回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
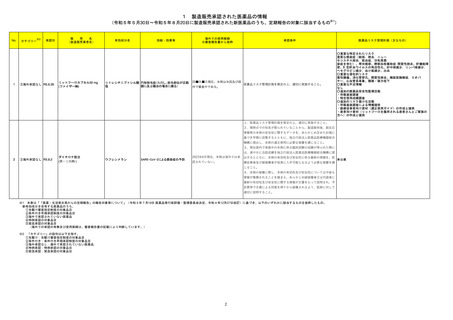
No.※2
23-06
一般名
アンピシリン水
和物
アンピシリンナ
トリウム
薬効
分類
613 主とし
てグラム陽
性・陰性菌
に作用する
もの
改訂内容
改訂理由
本剤投与後の肝機能検査値の最
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】 悪値が有害事象共通用語規準
(CTCAE v5.0)Grade3 以上に該当
現行
改訂案
する肝機能障害関連の国内症例
8. 重要な基本的注意
8. 重要な基本的注意
を評価した。症例の因果関係評価
(新設)
肝機能障害があらわれることがあるので、定期的に検査を行う
及び使用上の注意の改訂要否に
こと。
ついて、専門委員の意見も聴取し
た結果、本剤と肝機能障害との因
11. 副作用
11. 副作用
果関係の否定できない国内症例
11.1 重大な副作用
11.1 重大な副作用
が集積したことから、使用上の注
(新設)
肝機能障害
意を改訂することが適切と判断し
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。
た。
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
改訂案
副作用
副作用
重大な副作用
重大な副作用
(新設)
AST、ALTの上昇等を伴う肝機能障害があらわれることがある
ので、定期的に検査を行うなど観察を十分に行い、異常が認め
23-07
アンピシリン水
和物・クロキサ
シリンナトリウ
ム水和物
アンピシリンナ
トリウム・クロキ
サシリンナトリ
ウム水和物
られた場合には投与を中止し、適切な処置を行うこと。
619 その
他の抗生物
質製剤
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
8. 重要な基本的注意
(新設)
改訂案
8. 重要な基本的注意
肝機能障害があらわれることがあるので、定期的に検査を行う
こと。
11. 副作用
11. 副作用
11.1 重大な副作用
11.1 重大な副作用
(新設)
肝機能障害
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。
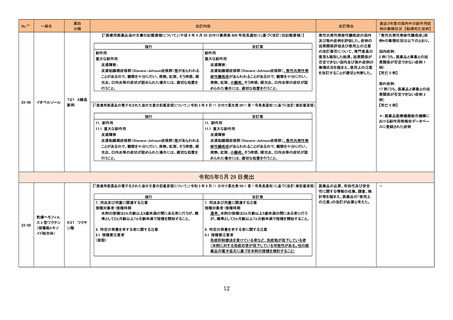
11
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
肝機能障害関連症例*の国内症
例の集積状況は以下のとおり。
①アンピシリン水和物
②アンピシリンナトリウム
③アンピシリン水和物・クロキサ
シリンナトリウム水和物
④アンピシリンナトリウム・クロキ
サシリンナトリウム水和物
① 3 例(うち、医薬品と事象との
因果関係が否定できない症例 0
例)
【死亡 0 例】
② 18 例(うち、医薬品と事象と
の因果関係が否定できない症例
3 例)
【死亡 0 例】
③④ 0 例
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例
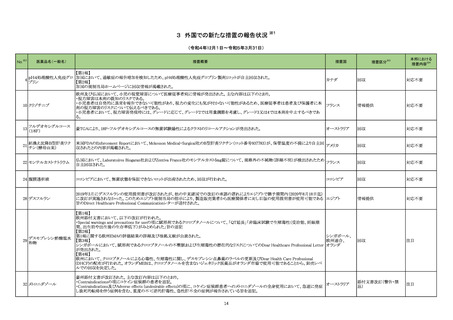
23-06
一般名
アンピシリン水
和物
アンピシリンナ
トリウム
薬効
分類
613 主とし
てグラム陽
性・陰性菌
に作用する
もの
改訂内容
改訂理由
本剤投与後の肝機能検査値の最
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】 悪値が有害事象共通用語規準
(CTCAE v5.0)Grade3 以上に該当
現行
改訂案
する肝機能障害関連の国内症例
8. 重要な基本的注意
8. 重要な基本的注意
を評価した。症例の因果関係評価
(新設)
肝機能障害があらわれることがあるので、定期的に検査を行う
及び使用上の注意の改訂要否に
こと。
ついて、専門委員の意見も聴取し
た結果、本剤と肝機能障害との因
11. 副作用
11. 副作用
果関係の否定できない国内症例
11.1 重大な副作用
11.1 重大な副作用
が集積したことから、使用上の注
(新設)
肝機能障害
意を改訂することが適切と判断し
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。
た。
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
改訂案
副作用
副作用
重大な副作用
重大な副作用
(新設)
AST、ALTの上昇等を伴う肝機能障害があらわれることがある
ので、定期的に検査を行うなど観察を十分に行い、異常が認め
23-07
アンピシリン水
和物・クロキサ
シリンナトリウ
ム水和物
アンピシリンナ
トリウム・クロキ
サシリンナトリ
ウム水和物
られた場合には投与を中止し、適切な処置を行うこと。
619 その
他の抗生物
質製剤
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
8. 重要な基本的注意
(新設)
改訂案
8. 重要な基本的注意
肝機能障害があらわれることがあるので、定期的に検査を行う
こと。
11. 副作用
11. 副作用
11.1 重大な副作用
11.1 重大な副作用
(新設)
肝機能障害
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。
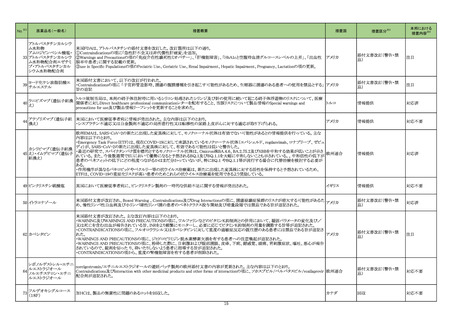
11
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
肝機能障害関連症例*の国内症
例の集積状況は以下のとおり。
①アンピシリン水和物
②アンピシリンナトリウム
③アンピシリン水和物・クロキサ
シリンナトリウム水和物
④アンピシリンナトリウム・クロキ
サシリンナトリウム水和物
① 3 例(うち、医薬品と事象との
因果関係が否定できない症例 0
例)
【死亡 0 例】
② 18 例(うち、医薬品と事象と
の因果関係が否定できない症例
3 例)
【死亡 0 例】
③④ 0 例
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例