よむ、つかう、まなぶ。
【資料3】医薬局からの定期報告[992KB] (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35321.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第13回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
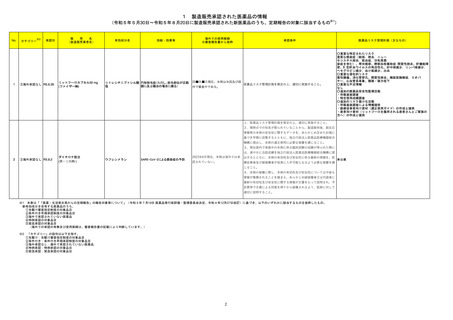
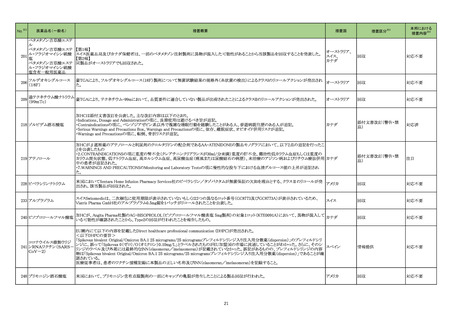
No.※2
医薬品名(一般名)
措置概要
措置区分※3
措置国
【第1報】
シンガポール添付文書が改訂され、シンガポールHSAのウェブサイトにて、医療従事者向けレターにて当該改訂を通知している。主な改訂内容は
以下のとおり。
・WARNINGS AND PRECAUTIONS及びADVERSE REACTIONSのPost-Authorization Experienceの項にアナフィラキシーを追加。
ニルマトレルビル・リトナビ
75
・DRUG INTERACTIONSのEstablished and Other Potentially Significant Drug Interactionsの項に、併用注意の位置づけで複数の薬剤が追加さ シンガポール
ル
れた。
本邦における
措置内容※4
情報提供
注目
添付文書改訂(警告・禁
忌)
注目
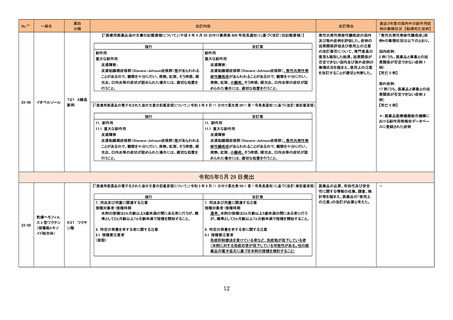
バゼドキシフェン/エストロゲン配合剤の米国添付文書が改訂され、Boxed warningに以下内容が追記された。
・Women's Health Initiative (WHI)におけるエストロゲン単独投与時のサブスタディでは0.625mg/日の抱合型エストロゲンが使用されている。その
ため、WHIで明らかになった心血管系事象及び認知症に関する所見が、より低用量のエストロゲン、他の投与経路でのエストロゲン、又は抱合型
アメリカ
以外のエストロゲン単独療法時において当てはまるかは不明である。一方、抱合型エストロゲン以外の製剤において、これらのリスクを明確に除外
することはできず、リスクの程度を判断することはできない。個々の患者のリスクプロファイルを考慮して、エストロゲン単独療法時のベネフィットリス
クを患者と議論すること。
添付文書改訂(警告・禁
忌)
注目
欧州及び豪州において実施中の第3相試験(高強度化学療法に適格なFLT3 変異を有する急性骨髄性白血病又は芽球増加を伴う骨髄異形成
症候群2と新規診断された患者を対象とした、寛解導入療法及び地固め療法との本剤又はmidostaurinの併用、その後1年の維持療法を行う多施
設共同非盲検無作為化第III相試験)において、感染症に関する安全性の懸念により組入れが一時中断された旨が治験責任医師宛に通知され
た。
情報提供
対応済
添付文書改訂(警告・禁
忌)
注目
【第2報】
誤記修正。措置内容に変更なし。
76 シスプラチン
80
エストロゲン〔結合型〕
バゼドキシフェン酢酸塩
81 ギルテリチニブフマル酸塩
豪州添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に、全身感染症が追記された。
・Special warnings and precautions for use及びInterations with other medicines and other forms of interactionsの項に、聴覚毒性を有する薬剤、
抗けいれん薬、抗痛風薬との併用に関する注意が追記された。
オーストラリア
オーストラリア、
欧州連合
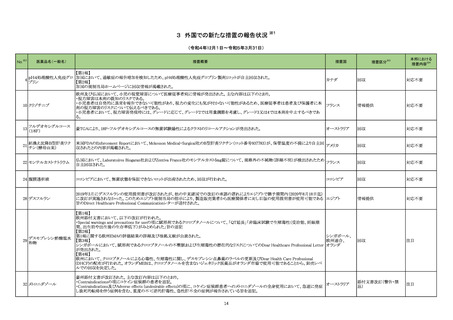
加HCがトラネキサム酸注射剤(GD-Tranexamic Acid)の添付文書の以下2項目の改訂が行われたことを報告したもの。
89 トラネキサム酸
・「2.Contraindications」の項に「トラネキサム酸の髄腔内および硬膜外投与は禁忌である。」が追加された。
カナダ
・「7.Warnings and Precautions」の項に「ホルモン避妊薬との併用は、静脈血栓塞栓症のリスクを高めるだけでなく、脳卒中や心筋梗塞などの動脈
血栓症のリスクを高める。」こと、「トラネキサム酸と血栓形成促進性の医薬品との併用は避けること。併用すると、トラネキサム酸に関連する血栓塞
栓性副作用のリスクがさらに高まる可能性がある。」ことの2点が追加された。
102 カプトプリル
オーストラリアTGAは、カプトプリルの製品情報の変更を発出した。変更箇所は以下の通り。
①禁忌の項に、アリスキレンフマル酸塩を投与中の糖尿病患者又は腎障害患者、およびサクビトリル/バルサルタン療法患者が追記された。
②警告の項に、ACE阻害剤とサクビトリル/バルサルタンの併用は、血管浮腫のリスクを高めるため禁忌である旨、サクビトリル/バルサルタン治療
はカプトプリルの投与後36時間以内に開始してはならない旨、および貧血、乏尿および白血球減少症に関するリスクが追記された。
③相互作用の項に、ACE阻害剤とサクビトリル/バルサルタンの併用注意が追記された。
④有害事象の項には、早産児における「乏尿」のリスクが追記された。
オーストラリア
添付文書改訂(警告・禁
忌)
注目
103 フロセミド
シンガポールHSAは、微生物による汚染のため、フロセミド製剤の1バッチのリコールを発表した。
シンガポール
回収
対応不要
16
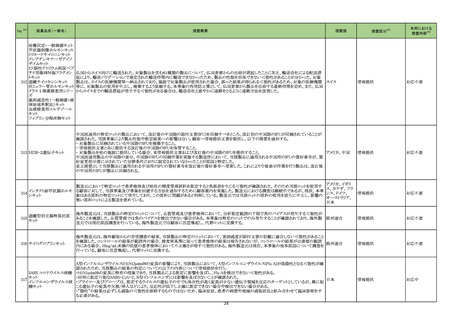
医薬品名(一般名)
措置概要
措置区分※3
措置国
【第1報】
シンガポール添付文書が改訂され、シンガポールHSAのウェブサイトにて、医療従事者向けレターにて当該改訂を通知している。主な改訂内容は
以下のとおり。
・WARNINGS AND PRECAUTIONS及びADVERSE REACTIONSのPost-Authorization Experienceの項にアナフィラキシーを追加。
ニルマトレルビル・リトナビ
75
・DRUG INTERACTIONSのEstablished and Other Potentially Significant Drug Interactionsの項に、併用注意の位置づけで複数の薬剤が追加さ シンガポール
ル
れた。
本邦における
措置内容※4
情報提供
注目
添付文書改訂(警告・禁
忌)
注目
バゼドキシフェン/エストロゲン配合剤の米国添付文書が改訂され、Boxed warningに以下内容が追記された。
・Women's Health Initiative (WHI)におけるエストロゲン単独投与時のサブスタディでは0.625mg/日の抱合型エストロゲンが使用されている。その
ため、WHIで明らかになった心血管系事象及び認知症に関する所見が、より低用量のエストロゲン、他の投与経路でのエストロゲン、又は抱合型
アメリカ
以外のエストロゲン単独療法時において当てはまるかは不明である。一方、抱合型エストロゲン以外の製剤において、これらのリスクを明確に除外
することはできず、リスクの程度を判断することはできない。個々の患者のリスクプロファイルを考慮して、エストロゲン単独療法時のベネフィットリス
クを患者と議論すること。
添付文書改訂(警告・禁
忌)
注目
欧州及び豪州において実施中の第3相試験(高強度化学療法に適格なFLT3 変異を有する急性骨髄性白血病又は芽球増加を伴う骨髄異形成
症候群2と新規診断された患者を対象とした、寛解導入療法及び地固め療法との本剤又はmidostaurinの併用、その後1年の維持療法を行う多施
設共同非盲検無作為化第III相試験)において、感染症に関する安全性の懸念により組入れが一時中断された旨が治験責任医師宛に通知され
た。
情報提供
対応済
添付文書改訂(警告・禁
忌)
注目
【第2報】
誤記修正。措置内容に変更なし。
76 シスプラチン
80
エストロゲン〔結合型〕
バゼドキシフェン酢酸塩
81 ギルテリチニブフマル酸塩
豪州添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に、全身感染症が追記された。
・Special warnings and precautions for use及びInterations with other medicines and other forms of interactionsの項に、聴覚毒性を有する薬剤、
抗けいれん薬、抗痛風薬との併用に関する注意が追記された。
オーストラリア
オーストラリア、
欧州連合
加HCがトラネキサム酸注射剤(GD-Tranexamic Acid)の添付文書の以下2項目の改訂が行われたことを報告したもの。
89 トラネキサム酸
・「2.Contraindications」の項に「トラネキサム酸の髄腔内および硬膜外投与は禁忌である。」が追加された。
カナダ
・「7.Warnings and Precautions」の項に「ホルモン避妊薬との併用は、静脈血栓塞栓症のリスクを高めるだけでなく、脳卒中や心筋梗塞などの動脈
血栓症のリスクを高める。」こと、「トラネキサム酸と血栓形成促進性の医薬品との併用は避けること。併用すると、トラネキサム酸に関連する血栓塞
栓性副作用のリスクがさらに高まる可能性がある。」ことの2点が追加された。
102 カプトプリル
オーストラリアTGAは、カプトプリルの製品情報の変更を発出した。変更箇所は以下の通り。
①禁忌の項に、アリスキレンフマル酸塩を投与中の糖尿病患者又は腎障害患者、およびサクビトリル/バルサルタン療法患者が追記された。
②警告の項に、ACE阻害剤とサクビトリル/バルサルタンの併用は、血管浮腫のリスクを高めるため禁忌である旨、サクビトリル/バルサルタン治療
はカプトプリルの投与後36時間以内に開始してはならない旨、および貧血、乏尿および白血球減少症に関するリスクが追記された。
③相互作用の項に、ACE阻害剤とサクビトリル/バルサルタンの併用注意が追記された。
④有害事象の項には、早産児における「乏尿」のリスクが追記された。
オーストラリア
添付文書改訂(警告・禁
忌)
注目
103 フロセミド
シンガポールHSAは、微生物による汚染のため、フロセミド製剤の1バッチのリコールを発表した。
シンガポール
回収
対応不要
16