よむ、つかう、まなぶ。
【資料3】医薬局からの定期報告[992KB] (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35321.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第13回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
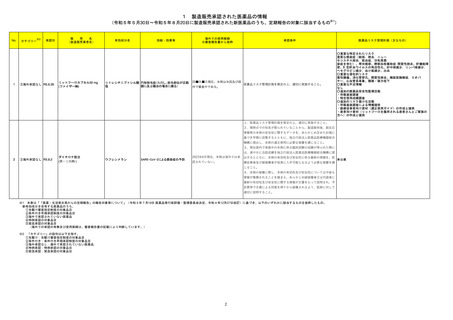
No.※2
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4
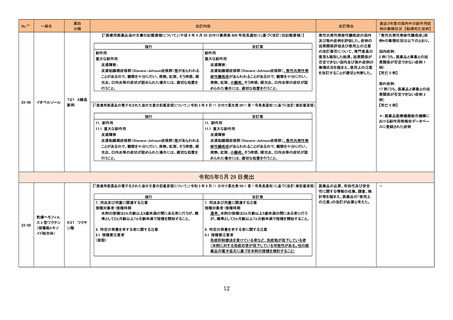
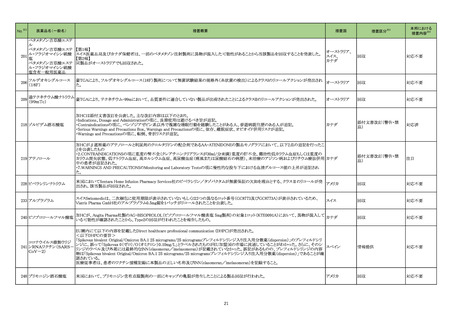
グリコヘモグロビンA1C
326
キット
海外製造元は、顧客からの苦情調査と社内調査の結果、特定の分析装置の専用試薬である当該製品の特定のロットにおいて、測定結果に偏り
や不正確性があることを確認した。この事象は、静脈血検体において確認され、最大の偏りは-15.7%で、最大の不正確性は3.7%であった。確認さ
れた偏りは当該製品の製造時におけるキャリブレーションの割り当てのずれによる可能性があり、不正確性については分析装置のミキシングシー 欧州連合
ケンスに起因している可能性がある。これら2つの現象が同時発生した場合において大きく偏った外れ値が発生する可能性がある。この事象は、
分析装置の次のソフトウェアバージョンで改善される予定である。海外製造元では当該ロットの使用を中止するよう顧客に依頼する。
情報提供
対応不要
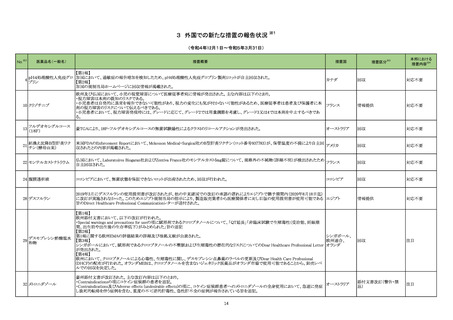
アラニンアミノトランスフェ
327
ラーゼキット
製造元において、当該製品の原料の一つであるアスコルビン酸オキシターゼの受入れ試験結果が規格内ではあるものの低下傾向を示したことか
アメリカ、イギリ
ら、当該製品のアスコルビン酸による干渉の影響を測定したところ、IFUに記載されている情報(干渉による誤差が生じない化合物とその濃度)と齟
ス、カナダ、フラ
齬が生じることが確認された。そのため製造元では当該製品を使用する顧客に対して本情報を周知するための顧客案内を実施した。
ンス、ドイツ、
本事象はロット間変動を十分に考慮せずにアスコルビン酸による干渉の影響を検証したことが原因であることが確認された。今後、製造元ではアス
オーストラリア
コルビン酸による測定値への影響を再評価し、その結果に基づきIFUを改訂する予定である。
情報提供
対応中
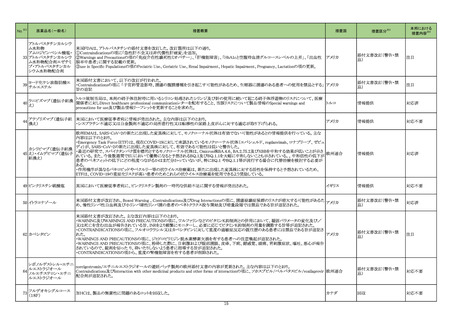
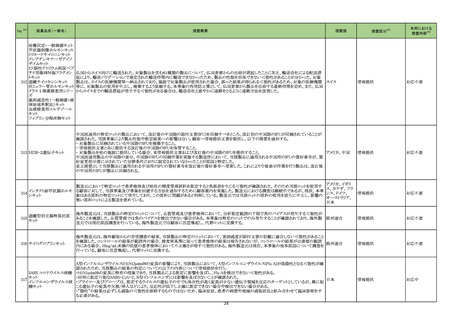
海外製造元は当該ロットのブロッキング試薬の濃度が不足していることを確認した。当該ロットの試薬で検査した患者検体は、干渉物質が十分に
遮断されていないことによって引き起こされ、再現性のある偽高値の結果を示す。製造元による社内調査の結果、患者検体の約15~20%が当該
不具合の影響を受けることを確認した。当該試薬で検査した患者検体の測定結果は、約30~80%高くなる可能性がある。この増加の程度は検体
中に存在する干渉物質の量により異なる可能性がある。製造元は、当該ロットの販売を中止し、顧客に対して以下の内容を通知した。
・当該ロットの製品の使用を中止し、在庫を廃棄すること
・過去の測定結果のレビューが必要かどうか、本通知文を検査室とメディカルダイレクターに共有することを推奨すること
アメリカ
・代替品への交換については、当社担当者に連絡すること
製造元による調査の結果、当該ロットの製造記録から、試薬カートリッジに充填されるバッファー調製の際、必要なブロッキング試薬量の計算を
誤っていたことが判明した。当該ロットの試薬については、ブロッキング試薬の使用量が少なかったため、一部の患者サンプルで測定結果が高く
なったと考えられる。なお、当該ロット以外はブロッキング試薬の使用量に問題ないことが確認されたため、波及性はないと判断した。製造元は、根
本原因の調査中である。
情報提供
対応不要
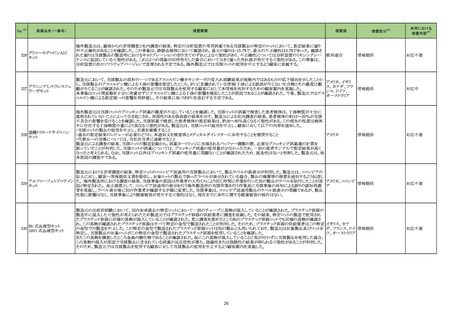
製造元における苦情調査の結果、特定ロットのコロンビア流通用の当該製品において、製品ラベルの誤表示が判明した。製造元は、コロンビアの
法人に対し、顧客へ情報提供文書を提供し、対象ロットの製品で誤ったラベルが表示されている場合、製品の廃棄等の措置を通知するよう伝達し
アルファーフェトプロテイン た。 海外製造所における調査の結果、当該事象の原因は作業者の人的ミスにより同じ時間に作業を行った別の製品のラベルを貼付したことが原 アメリカ、コロンビ
329
情報提供
キット
因と特定された。 是正措置として、コロンビア流通用の表示を行う海外製造所の当該作業を行う作業員に当該事象の周知による誤りの認知再教 ア
育を実施し、ラベル表示後に別の作業者が確認する手順に変更した。当該事象は、コロンビア流通用製品のラベル誤表示の問題であるが、製品
性能に影響はなく、当該事象により健康被害が発生する可能性はなく、現在までに本件に関する健康被害の報告はない。
対応不要
製造元の出荷前試験において、国内未承認品の特定ロットにおいて一部のチューブに異物が混入していることが確認された。プラスチック容器の
製造中に混入した可能性が考えられたため製造元ではプラスチック容器の供給業者に調査を依頼した。その結果、特定ロットの製造で使用され
たプラスチック容器に同様の異物が混入していることが確認された。更に調査を進めたところ他のプラスチック容器ロットでも同様の異物が確認さ
れ、この異物が確認されたプラスチック容器はすべて特定の金型で製造されたことが判明した。そのため、プラスチック容器の供給業者はこの特定 イギリス、カナ
の金型での製造を中止した。この特定の金型で製造されたプラスチック容器ロットは別の製品にも用いられており、製造元は対象製品及びロットを ダ、フランス、ドイ 情報提供
特定し、当該製品の対象ロットがこの特定の金型で製造されたプラスチック容器を使用していることを確認した。
ツ、オーストラリア
またこの異物を調査したところ金属の酸化物であることが確認された。仮にこの異物が混入していることに気が付かずに当該製品を使用した場合、
この異物の混入が原因で当該製品に含まれている試薬の反応活性が落ち、偽陽性または偽陰性の結果が得られる可能性があることが判明した。
そのため、製造元では当該製品を使用する顧客に対して当該製品の使用を中止するよう顧客案内を実施した。
対応不要
328
330
遊離トリヨードサイロニン
キット
Rh 式血液型キット
ABO 式血液型キット
26
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4
グリコヘモグロビンA1C
326
キット
海外製造元は、顧客からの苦情調査と社内調査の結果、特定の分析装置の専用試薬である当該製品の特定のロットにおいて、測定結果に偏り
や不正確性があることを確認した。この事象は、静脈血検体において確認され、最大の偏りは-15.7%で、最大の不正確性は3.7%であった。確認さ
れた偏りは当該製品の製造時におけるキャリブレーションの割り当てのずれによる可能性があり、不正確性については分析装置のミキシングシー 欧州連合
ケンスに起因している可能性がある。これら2つの現象が同時発生した場合において大きく偏った外れ値が発生する可能性がある。この事象は、
分析装置の次のソフトウェアバージョンで改善される予定である。海外製造元では当該ロットの使用を中止するよう顧客に依頼する。
情報提供
対応不要
アラニンアミノトランスフェ
327
ラーゼキット
製造元において、当該製品の原料の一つであるアスコルビン酸オキシターゼの受入れ試験結果が規格内ではあるものの低下傾向を示したことか
アメリカ、イギリ
ら、当該製品のアスコルビン酸による干渉の影響を測定したところ、IFUに記載されている情報(干渉による誤差が生じない化合物とその濃度)と齟
ス、カナダ、フラ
齬が生じることが確認された。そのため製造元では当該製品を使用する顧客に対して本情報を周知するための顧客案内を実施した。
ンス、ドイツ、
本事象はロット間変動を十分に考慮せずにアスコルビン酸による干渉の影響を検証したことが原因であることが確認された。今後、製造元ではアス
オーストラリア
コルビン酸による測定値への影響を再評価し、その結果に基づきIFUを改訂する予定である。
情報提供
対応中
海外製造元は当該ロットのブロッキング試薬の濃度が不足していることを確認した。当該ロットの試薬で検査した患者検体は、干渉物質が十分に
遮断されていないことによって引き起こされ、再現性のある偽高値の結果を示す。製造元による社内調査の結果、患者検体の約15~20%が当該
不具合の影響を受けることを確認した。当該試薬で検査した患者検体の測定結果は、約30~80%高くなる可能性がある。この増加の程度は検体
中に存在する干渉物質の量により異なる可能性がある。製造元は、当該ロットの販売を中止し、顧客に対して以下の内容を通知した。
・当該ロットの製品の使用を中止し、在庫を廃棄すること
・過去の測定結果のレビューが必要かどうか、本通知文を検査室とメディカルダイレクターに共有することを推奨すること
アメリカ
・代替品への交換については、当社担当者に連絡すること
製造元による調査の結果、当該ロットの製造記録から、試薬カートリッジに充填されるバッファー調製の際、必要なブロッキング試薬量の計算を
誤っていたことが判明した。当該ロットの試薬については、ブロッキング試薬の使用量が少なかったため、一部の患者サンプルで測定結果が高く
なったと考えられる。なお、当該ロット以外はブロッキング試薬の使用量に問題ないことが確認されたため、波及性はないと判断した。製造元は、根
本原因の調査中である。
情報提供
対応不要
製造元における苦情調査の結果、特定ロットのコロンビア流通用の当該製品において、製品ラベルの誤表示が判明した。製造元は、コロンビアの
法人に対し、顧客へ情報提供文書を提供し、対象ロットの製品で誤ったラベルが表示されている場合、製品の廃棄等の措置を通知するよう伝達し
アルファーフェトプロテイン た。 海外製造所における調査の結果、当該事象の原因は作業者の人的ミスにより同じ時間に作業を行った別の製品のラベルを貼付したことが原 アメリカ、コロンビ
329
情報提供
キット
因と特定された。 是正措置として、コロンビア流通用の表示を行う海外製造所の当該作業を行う作業員に当該事象の周知による誤りの認知再教 ア
育を実施し、ラベル表示後に別の作業者が確認する手順に変更した。当該事象は、コロンビア流通用製品のラベル誤表示の問題であるが、製品
性能に影響はなく、当該事象により健康被害が発生する可能性はなく、現在までに本件に関する健康被害の報告はない。
対応不要
製造元の出荷前試験において、国内未承認品の特定ロットにおいて一部のチューブに異物が混入していることが確認された。プラスチック容器の
製造中に混入した可能性が考えられたため製造元ではプラスチック容器の供給業者に調査を依頼した。その結果、特定ロットの製造で使用され
たプラスチック容器に同様の異物が混入していることが確認された。更に調査を進めたところ他のプラスチック容器ロットでも同様の異物が確認さ
れ、この異物が確認されたプラスチック容器はすべて特定の金型で製造されたことが判明した。そのため、プラスチック容器の供給業者はこの特定 イギリス、カナ
の金型での製造を中止した。この特定の金型で製造されたプラスチック容器ロットは別の製品にも用いられており、製造元は対象製品及びロットを ダ、フランス、ドイ 情報提供
特定し、当該製品の対象ロットがこの特定の金型で製造されたプラスチック容器を使用していることを確認した。
ツ、オーストラリア
またこの異物を調査したところ金属の酸化物であることが確認された。仮にこの異物が混入していることに気が付かずに当該製品を使用した場合、
この異物の混入が原因で当該製品に含まれている試薬の反応活性が落ち、偽陽性または偽陰性の結果が得られる可能性があることが判明した。
そのため、製造元では当該製品を使用する顧客に対して当該製品の使用を中止するよう顧客案内を実施した。
対応不要
328
330
遊離トリヨードサイロニン
キット
Rh 式血液型キット
ABO 式血液型キット
26