よむ、つかう、まなぶ。
【資料3】医薬局からの定期報告[992KB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35321.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第13回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
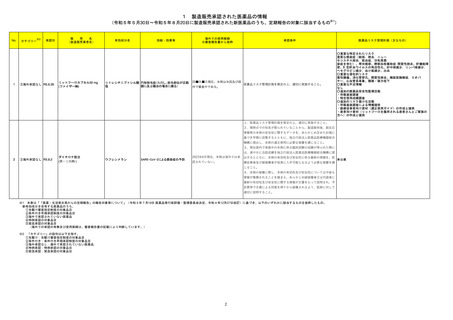
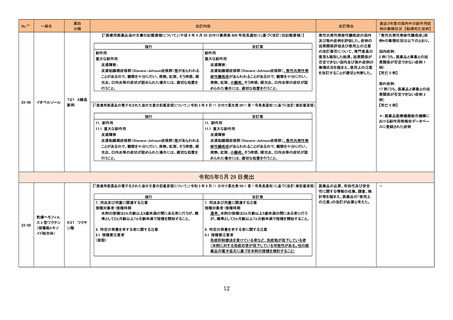
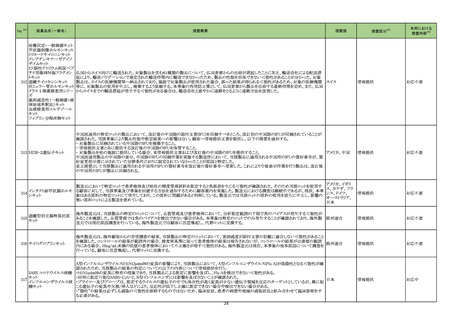
No.※2
医薬品名(一般名)
措置概要
措置区分※3
措置国
本邦における
措置内容※4
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
・Special warnings and precautions for useの項に、本剤でアナフィラキシー及び過敏症が報告されている旨、本剤の構成成分であるリトナビルで
中毒性表皮壊死融解症及びスティーヴンス・ジョンソン症候群が報告されている旨、臨床的に重要な過敏症やアナフィラキシーの症状または徴候
ニルマトレルビル・リトナビ
104
が発現したらただちに本剤を中止し適切な処置を行う旨を追記。
オランダ
ル
・Undesirable effectsの項に、そう痒症及び発疹を含む過敏症、アナフィラキシーを追記。
・Contraindications及びInteraction with other medicinal products and other forms of interactionの項に、併用禁忌または併用注意の位置づけで
複数の薬剤を追記。
添付文書改訂(警告・禁
忌)
対応済
【第1報】
治験責任医師宛に情報が発出された。主な内容は以下のとおり。
ニボルマブ(遺伝子組換
・進行性固形がん患者を対象としたBMS-986207の第I/IIa相first-in-human試験において、BMS-986207(抗TIGIT抗体)、ニボルマブ(遺伝子組換
え)
105
え)及びイピリムマブ(遺伝子組換え)の3剤併用療法パートで致死的な肺臓炎及び肺臓炎の発現率上昇を認めたことから、BMS-986207、ニボル アメリカ
イピリムマブ(遺伝子組換
マブ(遺伝子組換え)及びイピリムマブ(遺伝子組換え)の3剤併用療法を実施中の2試験で被験者登録を中断する。
え)
【第2報】
2試験のうち、1試験では3剤併用療法への被験者登録を中止し、1試験は試験を中止する。
情報提供
対応済
テトラキスメトキシイソブチ
ルイソニトリル銅(I)四フッ
化ホウ酸
106
ベンゾイルメルカプトアセ
チルグリシルグリシルグリ
シン
【第1報】
豪州TGAは、生体内分布の変化および一部画像での診断不能が生じることから該当ロットを回収した。
【第2報】
報告企業の意見が追記され、追加報されたもの。
オーストラリア
回収
注目
107 ゾルミトリプタン
欧州委員会はインドの特定の企業が生物学的同等性試験を実施した医薬品の製造販売承認を一時停止するよう要求し、フランスにおいて一部
のゾルミトリプタン製剤が該当したため2023年1月5日付で当該製剤の製造販売承認の停止、全バッチ回収が行われた。
フランス
回収
対応不要
欧州委員会はインドの特定の企業が生物学的同等性試験を実施した医薬品の製造販売承認を一時停止するよう要求し、フランスにおいて一部
アトルバスタチンカルシウ
のアトルバスタチン製剤が該当したため当該製剤の回収が行われた。 なお、新たな生物学的同等性試験の結果が良好であると判断されたため、 フランス
ム水和物
製造販売承認は停止されていない。
回収
対応不要
添付文書改訂(警告・禁
忌)
注目
添付文書改訂(警告・禁
忌)
対応済
108
エリスロマイシン全身製剤の欧州添付文書が改訂される。追記される主な内容は以下のとおり。
・Fertility, pregnancy and lactationのPregnancyの項に、エリスロマイシンを含むマクロライドの妊娠中の使用による主要な先天性奇形リスクに関す
る疫学研究結果は一貫していない旨
・Interaction with other medicinal products and other forms of interactionの項に、コルチコステロイドの曝露量増加の可能性があるため、主に
CYP3Aで代謝される全身または吸入コルチコステロイドとの併用には注意する旨、併用する場合はコルチコステロイドの副作用をよく観察する旨
エリスロマイシンステアリン ・Contraindications及びInteraction with other medicinal products and other forms of interactionの項に、トランスアミナーゼが顕著に上昇する可能
114
欧州連合
酸塩
性があるためロミタピドとの併用は禁忌である旨
・Interaction with other medicinal products and other forms of interactionの項に、エリスロマイシンは不整脈及び重篤な心血管イベントを誘発する
可能性があるため、QT間隔を延長することが知られているヒドロキシクロロキン及びchloroquineとの併用には注意する旨
【第2報】
措置内容に変更なし。企業見解が更新された。
115 ロミタピドメシル酸塩
欧州EMAは、エリスロマイシンの欧州添付文書を改訂し、併用禁忌薬にロミタピドを追加した。
17
アイルランド
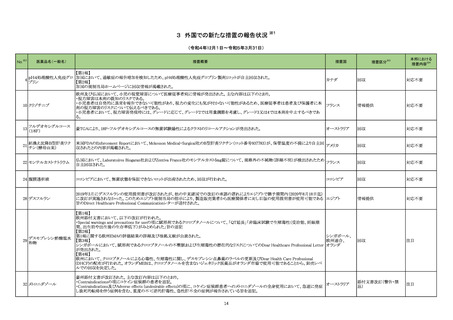
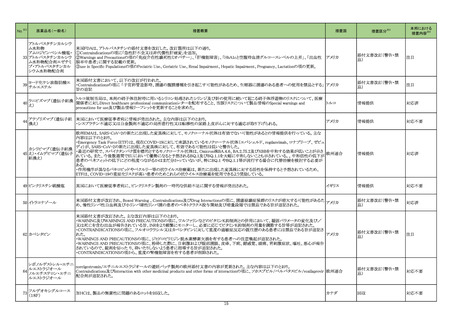
医薬品名(一般名)
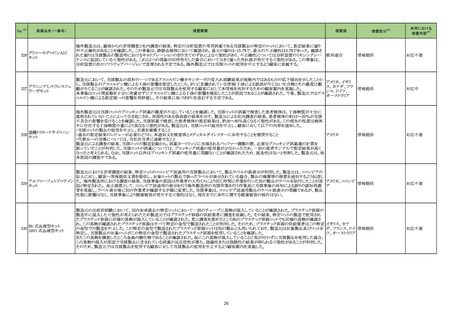
措置概要
措置区分※3
措置国
本邦における
措置内容※4
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
・Special warnings and precautions for useの項に、本剤でアナフィラキシー及び過敏症が報告されている旨、本剤の構成成分であるリトナビルで
中毒性表皮壊死融解症及びスティーヴンス・ジョンソン症候群が報告されている旨、臨床的に重要な過敏症やアナフィラキシーの症状または徴候
ニルマトレルビル・リトナビ
104
が発現したらただちに本剤を中止し適切な処置を行う旨を追記。
オランダ
ル
・Undesirable effectsの項に、そう痒症及び発疹を含む過敏症、アナフィラキシーを追記。
・Contraindications及びInteraction with other medicinal products and other forms of interactionの項に、併用禁忌または併用注意の位置づけで
複数の薬剤を追記。
添付文書改訂(警告・禁
忌)
対応済
【第1報】
治験責任医師宛に情報が発出された。主な内容は以下のとおり。
ニボルマブ(遺伝子組換
・進行性固形がん患者を対象としたBMS-986207の第I/IIa相first-in-human試験において、BMS-986207(抗TIGIT抗体)、ニボルマブ(遺伝子組換
え)
105
え)及びイピリムマブ(遺伝子組換え)の3剤併用療法パートで致死的な肺臓炎及び肺臓炎の発現率上昇を認めたことから、BMS-986207、ニボル アメリカ
イピリムマブ(遺伝子組換
マブ(遺伝子組換え)及びイピリムマブ(遺伝子組換え)の3剤併用療法を実施中の2試験で被験者登録を中断する。
え)
【第2報】
2試験のうち、1試験では3剤併用療法への被験者登録を中止し、1試験は試験を中止する。
情報提供
対応済
テトラキスメトキシイソブチ
ルイソニトリル銅(I)四フッ
化ホウ酸
106
ベンゾイルメルカプトアセ
チルグリシルグリシルグリ
シン
【第1報】
豪州TGAは、生体内分布の変化および一部画像での診断不能が生じることから該当ロットを回収した。
【第2報】
報告企業の意見が追記され、追加報されたもの。
オーストラリア
回収
注目
107 ゾルミトリプタン
欧州委員会はインドの特定の企業が生物学的同等性試験を実施した医薬品の製造販売承認を一時停止するよう要求し、フランスにおいて一部
のゾルミトリプタン製剤が該当したため2023年1月5日付で当該製剤の製造販売承認の停止、全バッチ回収が行われた。
フランス
回収
対応不要
欧州委員会はインドの特定の企業が生物学的同等性試験を実施した医薬品の製造販売承認を一時停止するよう要求し、フランスにおいて一部
アトルバスタチンカルシウ
のアトルバスタチン製剤が該当したため当該製剤の回収が行われた。 なお、新たな生物学的同等性試験の結果が良好であると判断されたため、 フランス
ム水和物
製造販売承認は停止されていない。
回収
対応不要
添付文書改訂(警告・禁
忌)
注目
添付文書改訂(警告・禁
忌)
対応済
108
エリスロマイシン全身製剤の欧州添付文書が改訂される。追記される主な内容は以下のとおり。
・Fertility, pregnancy and lactationのPregnancyの項に、エリスロマイシンを含むマクロライドの妊娠中の使用による主要な先天性奇形リスクに関す
る疫学研究結果は一貫していない旨
・Interaction with other medicinal products and other forms of interactionの項に、コルチコステロイドの曝露量増加の可能性があるため、主に
CYP3Aで代謝される全身または吸入コルチコステロイドとの併用には注意する旨、併用する場合はコルチコステロイドの副作用をよく観察する旨
エリスロマイシンステアリン ・Contraindications及びInteraction with other medicinal products and other forms of interactionの項に、トランスアミナーゼが顕著に上昇する可能
114
欧州連合
酸塩
性があるためロミタピドとの併用は禁忌である旨
・Interaction with other medicinal products and other forms of interactionの項に、エリスロマイシンは不整脈及び重篤な心血管イベントを誘発する
可能性があるため、QT間隔を延長することが知られているヒドロキシクロロキン及びchloroquineとの併用には注意する旨
【第2報】
措置内容に変更なし。企業見解が更新された。
115 ロミタピドメシル酸塩
欧州EMAは、エリスロマイシンの欧州添付文書を改訂し、併用禁忌薬にロミタピドを追加した。
17
アイルランド