よむ、つかう、まなぶ。
【資料3】医薬局からの定期報告[992KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35321.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第13回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
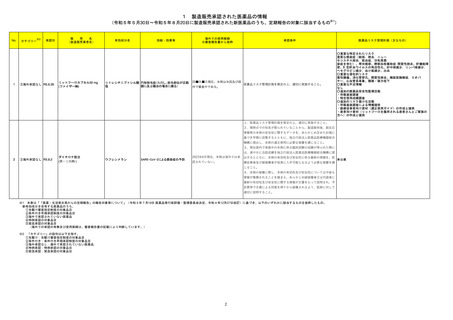
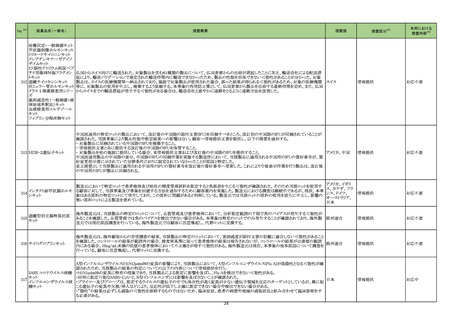
製造販売承認された医薬品の情報
(令和5年5月30日~令和5年8月20日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
カテゴリー
※2
承認日
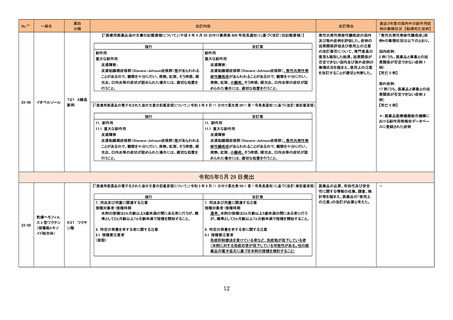
③海外承認なし R5.6.26
販
売
名
(製造販売業者名)
リットフーロカプセル50 mg
(ファイザー㈱)
有効成分名
効能・効果等
リトレシチニブトシル酸 円形脱毛症(ただし、脱毛部位が広範
塩
囲に及ぶ難治の場合に限る)
海外での使用実績
※審査報告書から抜粋
20■年■月現在、本剤は米国及び欧
州で審査中である。
承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
重篤な感染症(結核,肺炎,ニュー
モシスチス肺炎,敗血症,日和見感
染症を含む)、帯状疱疹、静脈血栓塞栓症 間質性肺炎、肝機能障
害、B 型肝炎ウイルスの再活性化、好中球減少,リンパ球減少,
ヘモグロビン減少,血小板減少、出血
○重要な潜在的リスク
悪性腫瘍、消化管穿孔、間質性肺炎、横紋筋融解症,ミオパ
チー、心血管系事象、難聴・聴力低下
○重要な不足情報
なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成と提供
・患者向け資材(リットフーロを服用される患者さんとご家族の
方へ)の作成と提供
1.医薬品リスク管理計画を策定の上、適切に実施すること。
2.現時点での知見が限られていることから、製造販売後、副反応
情報等の本剤の安全性に関するデータを、あらかじめ定めた計画に
基づき早期に収集するとともに、独立行政法人医薬品医療機器総合
機構に提出し、本剤の適正使用に必要な措置を講じること。
3.現在国内で実施中の本剤に係る臨床試験の成績が得られた際に
は、速やかに当該成績を独立行政法人医薬品医療機器総合機構に提
2
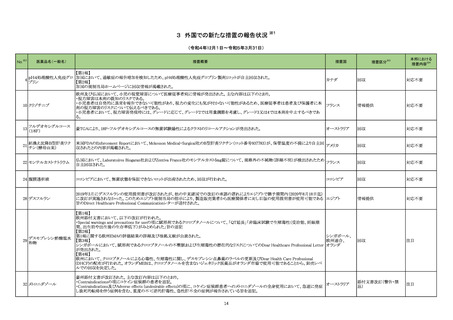
③海外承認なし R5.8.2
ダイチロナ筋注
(第一三共㈱ )
ウフレンメラン
SARS-CoV-2による感染症の予防
2023年6月現在、本剤は海外では承
出するとともに、本剤の有効性及び安全性に係る最新の情報を、医
認されていない。
療従事者及び被接種者が容易に入手可能となるよう必要な措置を講
じること。
4.本剤の接種に際し、本剤の有効性及び安全性については今後も
情報が集積されることを踏まえ、あらかじめ被接種者又は代諾者に
最新の有効性及び安全性に関する情報が文書をもって説明され、予
診票等で文書による同意を得てから接種されるよう、医師に対して
適切に説明すること。
※1 本表は「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定、令和4年12月27日改訂)に基づき、以下のいずれかに該当するものを抜粋したもの。
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
2
未公表
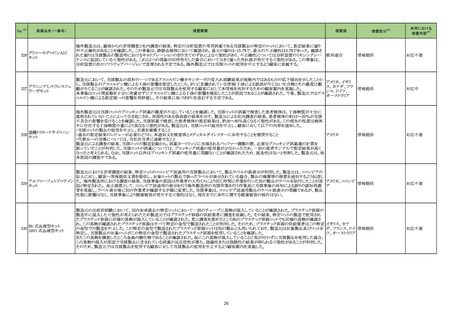
製造販売承認された医薬品の情報
(令和5年5月30日~令和5年8月20日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
カテゴリー
※2
承認日
③海外承認なし R5.6.26
販
売
名
(製造販売業者名)
リットフーロカプセル50 mg
(ファイザー㈱)
有効成分名
効能・効果等
リトレシチニブトシル酸 円形脱毛症(ただし、脱毛部位が広範
塩
囲に及ぶ難治の場合に限る)
海外での使用実績
※審査報告書から抜粋
20■年■月現在、本剤は米国及び欧
州で審査中である。
承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
重篤な感染症(結核,肺炎,ニュー
モシスチス肺炎,敗血症,日和見感
染症を含む)、帯状疱疹、静脈血栓塞栓症 間質性肺炎、肝機能障
害、B 型肝炎ウイルスの再活性化、好中球減少,リンパ球減少,
ヘモグロビン減少,血小板減少、出血
○重要な潜在的リスク
悪性腫瘍、消化管穿孔、間質性肺炎、横紋筋融解症,ミオパ
チー、心血管系事象、難聴・聴力低下
○重要な不足情報
なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成と提供
・患者向け資材(リットフーロを服用される患者さんとご家族の
方へ)の作成と提供
1.医薬品リスク管理計画を策定の上、適切に実施すること。
2.現時点での知見が限られていることから、製造販売後、副反応
情報等の本剤の安全性に関するデータを、あらかじめ定めた計画に
基づき早期に収集するとともに、独立行政法人医薬品医療機器総合
機構に提出し、本剤の適正使用に必要な措置を講じること。
3.現在国内で実施中の本剤に係る臨床試験の成績が得られた際に
は、速やかに当該成績を独立行政法人医薬品医療機器総合機構に提
2
③海外承認なし R5.8.2
ダイチロナ筋注
(第一三共㈱ )
ウフレンメラン
SARS-CoV-2による感染症の予防
2023年6月現在、本剤は海外では承
出するとともに、本剤の有効性及び安全性に係る最新の情報を、医
認されていない。
療従事者及び被接種者が容易に入手可能となるよう必要な措置を講
じること。
4.本剤の接種に際し、本剤の有効性及び安全性については今後も
情報が集積されることを踏まえ、あらかじめ被接種者又は代諾者に
最新の有効性及び安全性に関する情報が文書をもって説明され、予
診票等で文書による同意を得てから接種されるよう、医師に対して
適切に説明すること。
※1 本表は「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定、令和4年12月27日改訂)に基づき、以下のいずれかに該当するものを抜粋したもの。
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
2
未公表