よむ、つかう、まなぶ。
【資料3】医薬局からの定期報告[992KB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35321.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第13回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
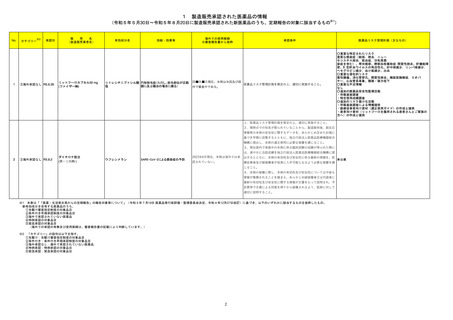
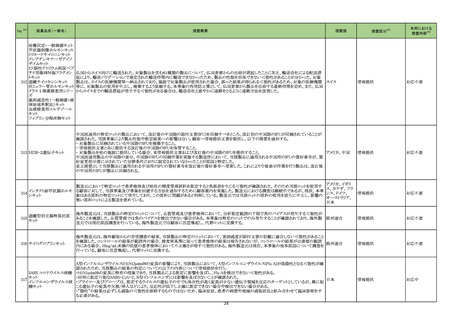
No.※2
一般名
薬効
分類
改訂内容
改訂理由
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
急性汎発性発疹性膿疱症の国内
及び海外症例を評価した。症例の
因果関係評価及び使用上の注意
の改訂要否について、専門委員の
意見も聴取した結果、因果関係が
否定できない国内及び海外症例の
集積状況を踏まえ、使用上の注意
を改訂することが適切と判断した。
現行
23-08
イオベルソール
721 X線造
影剤
改訂案
副作用
副作用
重大な副作用
重大な副作用
皮膚障害:
皮膚障害:
皮膚粘膜眼症候群(Stevens-Johnson症候群)等があらわれる
皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発
ことがあるので、観察を十分に行い、発熱、紅斑、そう痒感、眼
疹性膿疱症があらわれることがあるので、観察を十分に行い、
充血、口内炎等の症状が認められた場合には、適切な処置を
発熱、紅斑、小膿疱、そう痒感、眼充血、口内炎等の症状が認
行うこと。
められた場合には、適切な処置を行うこと。
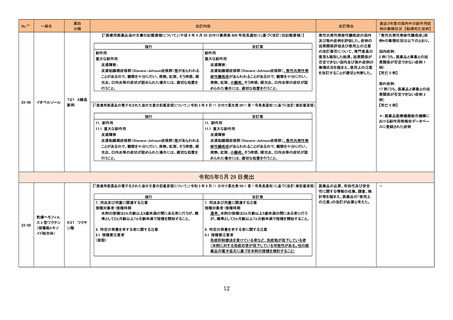
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
11. 副作用
11. 副作用
11.1 重大な副作用
11.1 重大な副作用
皮膚障害
皮膚障害
皮膚粘膜眼症候群(Stevens-Johnson症候群)等があらわれる
皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発
ことがあるので、観察を十分に行い、発熱、紅斑、そう痒感、眼
疹性膿疱症があらわれることがあるので、観察を十分に行い、
充血、口内炎等の症状が認められた場合には、適切な処置を
発熱、紅斑、小膿疱、そう痒感、眼充血、口内炎等の症状が認
行うこと。
められた場合には、適切な処置を行うこと。
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
「急性汎発性発疹性膿疱症」症
例*の集積状況は以下のとおり。
国内症例:
2 例(うち、医薬品と事象との因
果関係が否定できない症例 1
例)
【死亡 0 例】
海外症例:
17 例(うち、医薬品と事象との因
果関係が否定できない症例 3
例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例
令和5年5月 29 日発出
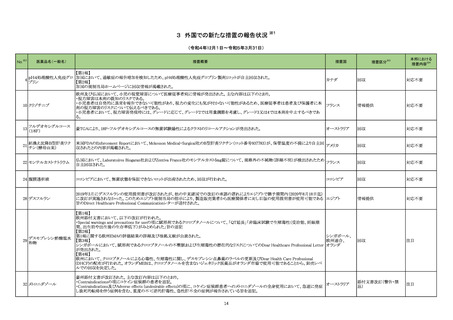
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】 医薬品の品質、有効性及び安全
性に関する情報の収集、調査、検
討等を踏まえ、医薬品の「使用上
現行
改訂案
の注意」の改訂が必要と考えた。
7. 用法及び用量に関連する注意
7. 用法及び用量に関連する注意
23-09
乾燥ヘモフィル
ス b 型ワクチン
(破傷風トキソ
イド結合体)
631 ワクチ
ン類
接種対象者・接種時期
本剤の接種は2ヵ月齢以上5歳未満の間にある者に行うが、標
準として2ヵ月齢以上7ヵ月齢未満で接種を開始すること。
接種対象者・接種時期
通常、本剤の接種は2ヵ月齢以上5歳未満の間にある者に行う
が、標準として2ヵ月齢以上7ヵ月齢未満で接種を開始すること。
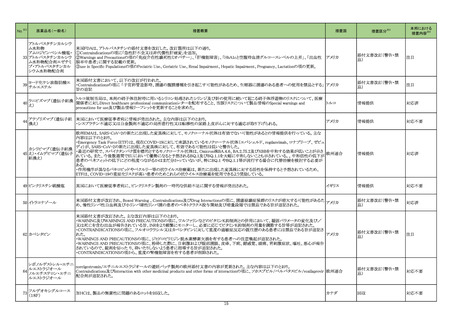
9. 特定の背景を有する者に関する注意
9.1 接種要注意者
(新設)
9. 特定の背景を有する者に関する注意
9.1 接種要注意者
免疫抑制療法を受けている者など、免疫能が低下している者
(本剤に対する免疫応答が低下している可能性がある。他の医
薬品の電子添文に基づき本剤の接種を検討すること)
12
-
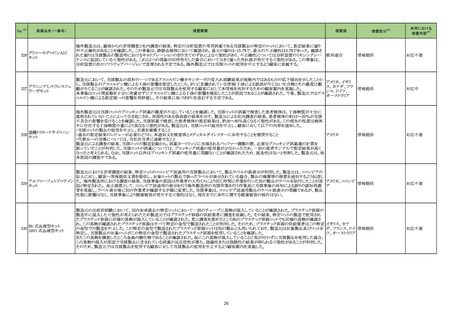
一般名
薬効
分類
改訂内容
改訂理由
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
急性汎発性発疹性膿疱症の国内
及び海外症例を評価した。症例の
因果関係評価及び使用上の注意
の改訂要否について、専門委員の
意見も聴取した結果、因果関係が
否定できない国内及び海外症例の
集積状況を踏まえ、使用上の注意
を改訂することが適切と判断した。
現行
23-08
イオベルソール
721 X線造
影剤
改訂案
副作用
副作用
重大な副作用
重大な副作用
皮膚障害:
皮膚障害:
皮膚粘膜眼症候群(Stevens-Johnson症候群)等があらわれる
皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発
ことがあるので、観察を十分に行い、発熱、紅斑、そう痒感、眼
疹性膿疱症があらわれることがあるので、観察を十分に行い、
充血、口内炎等の症状が認められた場合には、適切な処置を
発熱、紅斑、小膿疱、そう痒感、眼充血、口内炎等の症状が認
行うこと。
められた場合には、適切な処置を行うこと。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
11. 副作用
11. 副作用
11.1 重大な副作用
11.1 重大な副作用
皮膚障害
皮膚障害
皮膚粘膜眼症候群(Stevens-Johnson症候群)等があらわれる
皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発
ことがあるので、観察を十分に行い、発熱、紅斑、そう痒感、眼
疹性膿疱症があらわれることがあるので、観察を十分に行い、
充血、口内炎等の症状が認められた場合には、適切な処置を
発熱、紅斑、小膿疱、そう痒感、眼充血、口内炎等の症状が認
行うこと。
められた場合には、適切な処置を行うこと。
直近3年度の国内外の副作用症
例の集積状況 【転帰死亡症例】
「急性汎発性発疹性膿疱症」症
例*の集積状況は以下のとおり。
国内症例:
2 例(うち、医薬品と事象との因
果関係が否定できない症例 1
例)
【死亡 0 例】
海外症例:
17 例(うち、医薬品と事象との因
果関係が否定できない症例 3
例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベー
スに登録された症例
令和5年5月 29 日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】 医薬品の品質、有効性及び安全
性に関する情報の収集、調査、検
討等を踏まえ、医薬品の「使用上
現行
改訂案
の注意」の改訂が必要と考えた。
7. 用法及び用量に関連する注意
7. 用法及び用量に関連する注意
23-09
乾燥ヘモフィル
ス b 型ワクチン
(破傷風トキソ
イド結合体)
631 ワクチ
ン類
接種対象者・接種時期
本剤の接種は2ヵ月齢以上5歳未満の間にある者に行うが、標
準として2ヵ月齢以上7ヵ月齢未満で接種を開始すること。
接種対象者・接種時期
通常、本剤の接種は2ヵ月齢以上5歳未満の間にある者に行う
が、標準として2ヵ月齢以上7ヵ月齢未満で接種を開始すること。
9. 特定の背景を有する者に関する注意
9.1 接種要注意者
(新設)
9. 特定の背景を有する者に関する注意
9.1 接種要注意者
免疫抑制療法を受けている者など、免疫能が低下している者
(本剤に対する免疫応答が低下している可能性がある。他の医
薬品の電子添文に基づき本剤の接種を検討すること)
12
-