よむ、つかう、まなぶ。
資料1-2 ベポタスチンベシル酸塩のリスク評価について[4.5MB] (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35991.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第12回 10/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
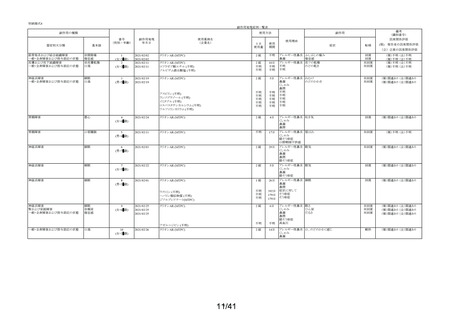
本剤の適正使用状況(「してはいけないこと」
「相談すること」
「用法・用量」
「効能・効果」等の
遵守)について、副作用頻度調査における調査開始から当該調査期間(第 2 次:2021 年 12 月 10
日~2022 年 12 月 9 日)までの 3,244 例の使用者アンケートの記載状況を記載する。
アンケートは使用者自身が記載したものであり、疾患名、薬剤名を含め、薬剤師が記載したも
のではない。
①「してはいけないこと」について
※1
アンケート項目ごとの事象別副作用については別表「集計表(アンケート別副作用件数入
り)」の対応するアンケート番号を参照(以下同様)
アンケー
ト番号※1
アンケート
割合
(例数)
副作用
発現例数
①-1
「以前に,薬を使用してアレルギー症状を起こしたことが
ありますか?」の質問に
「ある」と回答して、原因が「タリオン*1 *1:医療機関で処方
された「タリオン」も含みます。
」と回答された使用者
0.2%
(5)
0
①-2
「15 歳未満の小児」に該当した使用者
①-3
「授乳中」と回答された使用者
0.1%
(4)
0.1%
(4)
1
0
「以前に,
「腎臓病」*2と診断されたことがありますか?
①-4
*2;腎不全などの重い腎臓の病気に限らず、腎臓の機能(老廃物を体外に排
泄する能力)が低下しているような場合を含みます。 」
の質問に
「ある」と回答された使用者
①-5
「タリオン AR」を使用中に他に使用していた薬はありま
したか?(のみ薬、塗り薬等すべて)
」の質問に
「あり」と回答して、添付文書記載の「本剤を服用してい
る間は使用しないでください」に該当する医薬品※の記載
があった使用者
1.0%
(33)
4
2.7%
(88)
3
上記は重複回答を含む
本剤の添付文書「してはいけないこと」の項の記載事項に対応するアンケート項目について、
該当する使用者の回答割合は上記の表に示したとおりであった。
「以前に,薬を使用してアレルギー症状を起こしたことがありますか?」の質問に「ある」と
回答して、原因が「タリオン」と記載された使用者 5 例について、副作用の発現はなかった。
「以前に「腎臓病」と診断されたことがありますか?」の質問に「あり」と回答された使用者
33 例について約半数が腎盂炎や腎炎で、「腎不全」等の腎機能の改善が困難な重い腎疾患の記載
はなかった。また、この質問に「あり」と回答された使用者 33 例について、
「
「タリオン AR」を使
用する時点で、医師の治療を受けている病気がありましたか?」の質問に、腎臓病関連の記載を
された使用者は 1 例(腎炎)であった。
なお、この 1 名は本剤の投与開始日に「口渇」が発現し、10 日間服用の後、本剤の投与を中止
して「口渇」は回復した。
(回復日不明)
「本剤を服用している間は使用しないでください」に該当する医薬品※2 の記載があった使用者
88 例について、その内訳は、
「エピナスチン塩酸塩」
「フェキソフェナジン塩酸塩」
「ロラタジン」
「セチリジン塩酸塩」等の薬局で購入可能な市販薬の第 2 世代抗ヒスタミン剤の内服薬を記載し
た人が 32%(28 例/88 例)見られた。
「フルチカゾンフランカルボン酸エステル」「フルチカゾンプ
ロピオン酸エステル」の点鼻剤が 23%(20 例/88 例)、
「エピナスチン塩酸塩点眼」の点眼剤と記載
した人が 11%(10 例/88 例)で、投与経路の異なる薬剤を使用していた。また、
「モンテルカスト
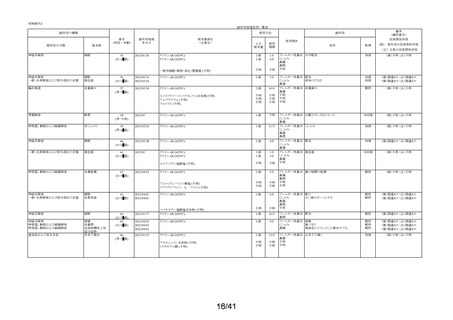
23/41
「相談すること」
「用法・用量」
「効能・効果」等の
遵守)について、副作用頻度調査における調査開始から当該調査期間(第 2 次:2021 年 12 月 10
日~2022 年 12 月 9 日)までの 3,244 例の使用者アンケートの記載状況を記載する。
アンケートは使用者自身が記載したものであり、疾患名、薬剤名を含め、薬剤師が記載したも
のではない。
①「してはいけないこと」について
※1
アンケート項目ごとの事象別副作用については別表「集計表(アンケート別副作用件数入
り)」の対応するアンケート番号を参照(以下同様)
アンケー
ト番号※1
アンケート
割合
(例数)
副作用
発現例数
①-1
「以前に,薬を使用してアレルギー症状を起こしたことが
ありますか?」の質問に
「ある」と回答して、原因が「タリオン*1 *1:医療機関で処方
された「タリオン」も含みます。
」と回答された使用者
0.2%
(5)
0
①-2
「15 歳未満の小児」に該当した使用者
①-3
「授乳中」と回答された使用者
0.1%
(4)
0.1%
(4)
1
0
「以前に,
「腎臓病」*2と診断されたことがありますか?
①-4
*2;腎不全などの重い腎臓の病気に限らず、腎臓の機能(老廃物を体外に排
泄する能力)が低下しているような場合を含みます。 」
の質問に
「ある」と回答された使用者
①-5
「タリオン AR」を使用中に他に使用していた薬はありま
したか?(のみ薬、塗り薬等すべて)
」の質問に
「あり」と回答して、添付文書記載の「本剤を服用してい
る間は使用しないでください」に該当する医薬品※の記載
があった使用者
1.0%
(33)
4
2.7%
(88)
3
上記は重複回答を含む
本剤の添付文書「してはいけないこと」の項の記載事項に対応するアンケート項目について、
該当する使用者の回答割合は上記の表に示したとおりであった。
「以前に,薬を使用してアレルギー症状を起こしたことがありますか?」の質問に「ある」と
回答して、原因が「タリオン」と記載された使用者 5 例について、副作用の発現はなかった。
「以前に「腎臓病」と診断されたことがありますか?」の質問に「あり」と回答された使用者
33 例について約半数が腎盂炎や腎炎で、「腎不全」等の腎機能の改善が困難な重い腎疾患の記載
はなかった。また、この質問に「あり」と回答された使用者 33 例について、
「
「タリオン AR」を使
用する時点で、医師の治療を受けている病気がありましたか?」の質問に、腎臓病関連の記載を
された使用者は 1 例(腎炎)であった。
なお、この 1 名は本剤の投与開始日に「口渇」が発現し、10 日間服用の後、本剤の投与を中止
して「口渇」は回復した。
(回復日不明)
「本剤を服用している間は使用しないでください」に該当する医薬品※2 の記載があった使用者
88 例について、その内訳は、
「エピナスチン塩酸塩」
「フェキソフェナジン塩酸塩」
「ロラタジン」
「セチリジン塩酸塩」等の薬局で購入可能な市販薬の第 2 世代抗ヒスタミン剤の内服薬を記載し
た人が 32%(28 例/88 例)見られた。
「フルチカゾンフランカルボン酸エステル」「フルチカゾンプ
ロピオン酸エステル」の点鼻剤が 23%(20 例/88 例)、
「エピナスチン塩酸塩点眼」の点眼剤と記載
した人が 11%(10 例/88 例)で、投与経路の異なる薬剤を使用していた。また、
「モンテルカスト
23/41