よむ、つかう、まなぶ。
資 料 3-2 令和5年度第1回安全技術調査会の審議結果について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36762.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会運営委員会(令和5年度第3回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
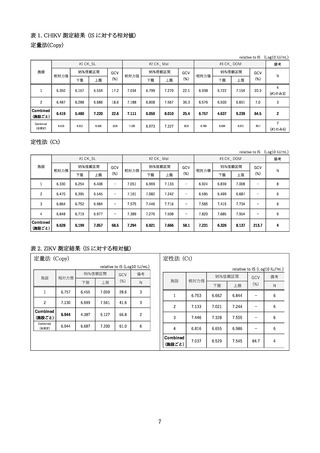
2) パネルの調製(表2)
材料として、HBV, HCV, HIV-1 国内標準品を用いて評価用のパネルを作製した。国
内標準品の希釈には、陰性血漿 (HCV 抗体、HBs 抗原、HIV-1/2 抗体、及び HBV、HCV、
HIV-1/2、HEV の NAT 全てが陰性)、あるいは 3 ウイルスの何れかが高濃度 (>104
IU/mL) に含まれる陽性血漿を用いた。標的ウイルスの低濃度陽性検体として、輸血用
血液の NAT で必要とされる検出限界値 (HBV: 100 IU/mL, HCV: 100 IU/mL, HIV-1:
200 IU/mL) の 1.5 倍あるいは 3 倍濃度にあたる 300 IU/mL に検体を希釈調製した。陰
性対照検体も含めた計 10 検体をブラインド化したパネルを参加施設に送付した。
3) 測定
血漿分画製剤の原料血漿プール NAT 実施施設と試薬メーカーは、コバス TaqScreen
MPX v2.0 (ロシュ・ダイアグノスティックス株式会社) を用いて測定した。この試験法
は HBV, HCV, HIV-1/2 の 3 ウイルスを検出すると同時に種類を同定する。参加施設は
上記の 10 検体についてそれぞれ日を変えて 3 回測定した。
4) 結果
(1) 血漿分画製剤の原料血漿プール NAT(表3および4)
血漿分画製剤の原料血漿プール NAT 実施施設全 5 施設において改正後の NAT ガイ
ドラインに基づいて実施している NAT 試験は、HBV、HCV、および HIV-1 に関する精
度管理が適切に実施されていた。全施設において HBV、HCV、および HIV-1 の低濃度
(300 IU/mL) に希釈された検体および高濃度の他のウイルスが混在した検体 (>104
IU/mL) でも標的のウイルスが特異的に検出・同定できることが確認された。陰性対照
は全て陰性と判定された。なお HIV-1 国内標準品にはごく微量の HBV DNA が混在す
ることが確認されている (平成 26 年度 第 2 回血液事業部会安全技術調査会報告事項)。
従って、HIV-1 陽性血漿 (>104 IU/mL) を用いて作製した低濃度 HCV 陽性検体は、
HIV-1 と HCV だけでなく、HBV も検出され得ることが想定される。
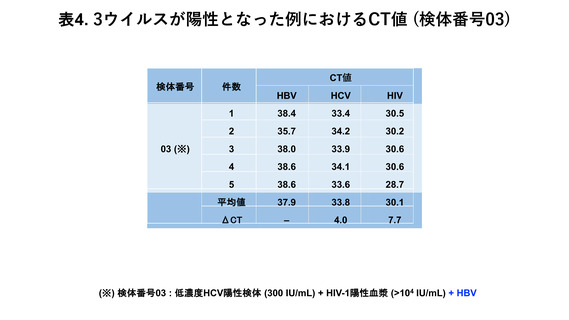
表4に示した通り、
当該検体 (検体番号 03) における測定結果では全ての施設で HIV1 と HCV が検出・同定されている。さらに 5 施設の合計 45 回の測定機会のうち、5 回
で HBV が検出された。この 5 回の検出機会における各ウイルスの CT 値は、ウイルス
量の多い順から、HIV-1 が 28.7~30.6 (平均値: 30.1)、HCV が 33.4~34.2 (平均値: 33.8)、
HBV が 35.7~38.6 (平均値: 37.9) であった。HBV の平均 CT 値に対するΔCT は HIV-1
が 7.7、HCV が 4.0 であった。
(2) 試薬メーカーにおける NAT
オブザーバーとして参加した試薬メーカーにて実施されている NAT 試験は HBV、
HCV、および HIV-1 の低濃度 (300 IU/mL) に希釈された検体および高濃度の他のウイ
2
4
14
材料として、HBV, HCV, HIV-1 国内標準品を用いて評価用のパネルを作製した。国
内標準品の希釈には、陰性血漿 (HCV 抗体、HBs 抗原、HIV-1/2 抗体、及び HBV、HCV、
HIV-1/2、HEV の NAT 全てが陰性)、あるいは 3 ウイルスの何れかが高濃度 (>104
IU/mL) に含まれる陽性血漿を用いた。標的ウイルスの低濃度陽性検体として、輸血用
血液の NAT で必要とされる検出限界値 (HBV: 100 IU/mL, HCV: 100 IU/mL, HIV-1:
200 IU/mL) の 1.5 倍あるいは 3 倍濃度にあたる 300 IU/mL に検体を希釈調製した。陰
性対照検体も含めた計 10 検体をブラインド化したパネルを参加施設に送付した。
3) 測定
血漿分画製剤の原料血漿プール NAT 実施施設と試薬メーカーは、コバス TaqScreen
MPX v2.0 (ロシュ・ダイアグノスティックス株式会社) を用いて測定した。この試験法
は HBV, HCV, HIV-1/2 の 3 ウイルスを検出すると同時に種類を同定する。参加施設は
上記の 10 検体についてそれぞれ日を変えて 3 回測定した。
4) 結果
(1) 血漿分画製剤の原料血漿プール NAT(表3および4)
血漿分画製剤の原料血漿プール NAT 実施施設全 5 施設において改正後の NAT ガイ
ドラインに基づいて実施している NAT 試験は、HBV、HCV、および HIV-1 に関する精
度管理が適切に実施されていた。全施設において HBV、HCV、および HIV-1 の低濃度
(300 IU/mL) に希釈された検体および高濃度の他のウイルスが混在した検体 (>104
IU/mL) でも標的のウイルスが特異的に検出・同定できることが確認された。陰性対照
は全て陰性と判定された。なお HIV-1 国内標準品にはごく微量の HBV DNA が混在す
ることが確認されている (平成 26 年度 第 2 回血液事業部会安全技術調査会報告事項)。
従って、HIV-1 陽性血漿 (>104 IU/mL) を用いて作製した低濃度 HCV 陽性検体は、
HIV-1 と HCV だけでなく、HBV も検出され得ることが想定される。
表4に示した通り、
当該検体 (検体番号 03) における測定結果では全ての施設で HIV1 と HCV が検出・同定されている。さらに 5 施設の合計 45 回の測定機会のうち、5 回
で HBV が検出された。この 5 回の検出機会における各ウイルスの CT 値は、ウイルス
量の多い順から、HIV-1 が 28.7~30.6 (平均値: 30.1)、HCV が 33.4~34.2 (平均値: 33.8)、
HBV が 35.7~38.6 (平均値: 37.9) であった。HBV の平均 CT 値に対するΔCT は HIV-1
が 7.7、HCV が 4.0 であった。
(2) 試薬メーカーにおける NAT
オブザーバーとして参加した試薬メーカーにて実施されている NAT 試験は HBV、
HCV、および HIV-1 の低濃度 (300 IU/mL) に希釈された検体および高濃度の他のウイ
2
4
14