よむ、つかう、まなぶ。
資 料 3-2 令和5年度第1回安全技術調査会の審議結果について (55 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36762.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会運営委員会(令和5年度第3回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
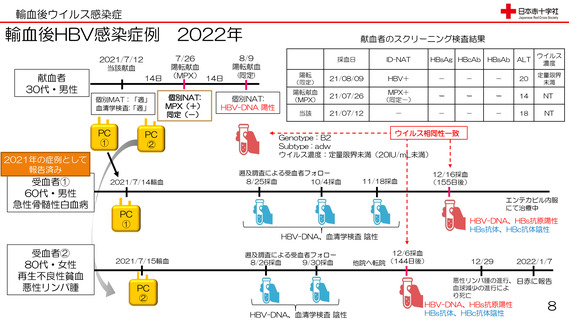
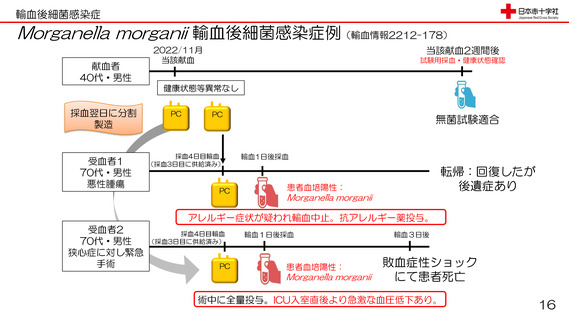
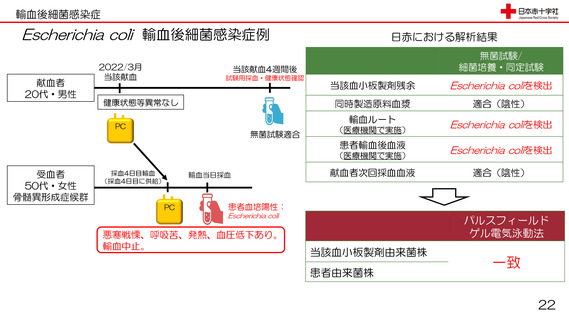
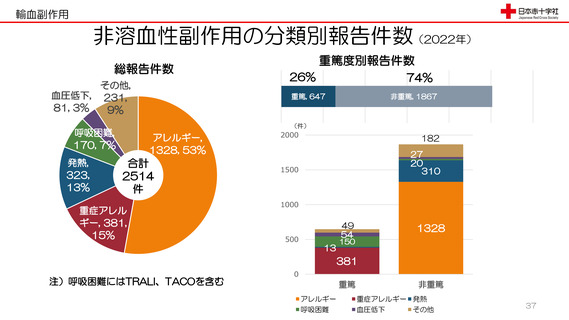
輸血後細菌感染症
関連学会への情報提供
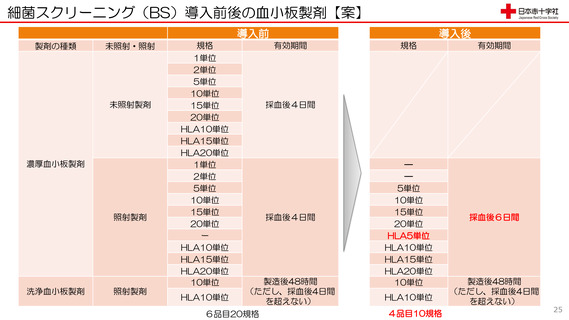
細菌スクリーニング導入に伴う
製品規格等の変更点
1. 血小板製剤全品に培養による細菌ス
クリーニングを実施します
2. 血小板製剤の有効期間を採血後4日
間から6日間に延長します(ただし、
洗浄血小板製剤については有効期間
の変更はございません)
3. HLA 適合血小板製剤に5単位製剤
を追加します
4. 製造販売する血小板製剤はすべて放
射線照射した製剤となります
5. 血小板製剤の1単位及び2単位製剤
は製造販売しないこととします
33
54
関連学会への情報提供
細菌スクリーニング導入に伴う
製品規格等の変更点
1. 血小板製剤全品に培養による細菌ス
クリーニングを実施します
2. 血小板製剤の有効期間を採血後4日
間から6日間に延長します(ただし、
洗浄血小板製剤については有効期間
の変更はございません)
3. HLA 適合血小板製剤に5単位製剤
を追加します
4. 製造販売する血小板製剤はすべて放
射線照射した製剤となります
5. 血小板製剤の1単位及び2単位製剤
は製造販売しないこととします
33
54