よむ、つかう、まなぶ。
資料1-2 セイヨウトチノキ種子エキスのリスク評価について[4.6MB] (16 ページ)
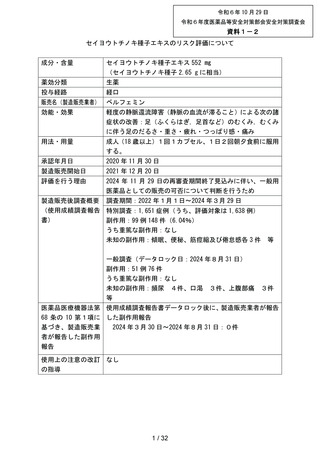
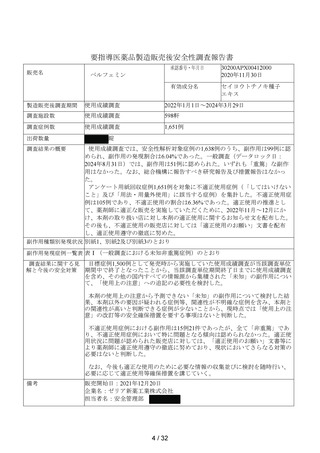
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44431.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第8回 10/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2)
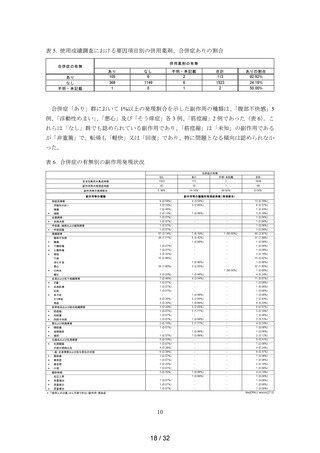
承認時までの副作用・感染症の発現状況
承認時までの副作用の発現状況を表 3 に示した。承認時までの安全性解析対象症例 70 例
のうち、副作用は 5 例 5 件に認められ、副作用の発現割合は 7.1%であった。副作用の種類
は、
「軟便」2 例、
「便秘」、
「悪心」及び「局所腫脹」が各 1 例であり、
「重篤」な副作用はな
かった。
表 3. 承認時までの副作用・感染症の発現状況
調査・試験名:第III相一般臨床試験(非対照試験)
承認時までの状況
70
安全性解析対象症例数
副作用等の発現症例数
5
副作用等の発現割合
7.1%
副作用等の種類別発現症例数
(発現割合)
4 (5.7%)
副作用等の種類
胃腸障害
便秘
1 (1.4%)
悪心
1 (1.4%)
軟便
2 (2.9%)
1 (1.4%)
一般・全身障害および投与部位の状態
1 (1.4%)
局所腫脹
MedDRA/J version(17.0)
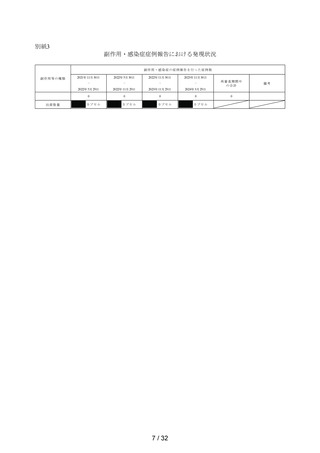
本調査の副作用発現割合は 6.04%(99/1,638 例)であり、承認時までの試験での 7.1%
(5/70 例)を上回らなかった。承認時までの試験における副作用の器官別大分類別の発現
割合は「胃腸障害」5.7%(4/70 例)、「一般・全身障害および投与部位の状態」1.4%
(1/70 例)であったが、本調査ではそれぞれ「胃腸障害」は 3.97%(65/1,638 例)、「一
般・全身障害および投与部位の状態」は 0.37%(6/1,638 例)であり、承認時までの試験と
比較して上回っておらず、本調査で認めた副作用の発現傾向は承認時までの試験と同様で
あり、問題を認めなかった。
2.2.2. 副作用発現に影響を及ぼす要因
安全性解析対象症例における患者背景別の副作用発現割合は、表 4 の通りであった。統計
学的解析は χ2 検定又は Fisher の直接確率法にて p 値を求め、有意水準を 5%とした(「不明・
未記載」は検定から除いた)。
その結果、「合併症」の有無、「併用薬剤」の有無及び「服用期間(日)
」において、副作
用発現割合に有意な差が認められた。
8
16 / 32
承認時までの副作用・感染症の発現状況
承認時までの副作用の発現状況を表 3 に示した。承認時までの安全性解析対象症例 70 例
のうち、副作用は 5 例 5 件に認められ、副作用の発現割合は 7.1%であった。副作用の種類
は、
「軟便」2 例、
「便秘」、
「悪心」及び「局所腫脹」が各 1 例であり、
「重篤」な副作用はな
かった。
表 3. 承認時までの副作用・感染症の発現状況
調査・試験名:第III相一般臨床試験(非対照試験)
承認時までの状況
70
安全性解析対象症例数
副作用等の発現症例数
5
副作用等の発現割合
7.1%
副作用等の種類別発現症例数
(発現割合)
4 (5.7%)
副作用等の種類
胃腸障害
便秘
1 (1.4%)
悪心
1 (1.4%)
軟便
2 (2.9%)
1 (1.4%)
一般・全身障害および投与部位の状態
1 (1.4%)
局所腫脹
MedDRA/J version(17.0)
本調査の副作用発現割合は 6.04%(99/1,638 例)であり、承認時までの試験での 7.1%
(5/70 例)を上回らなかった。承認時までの試験における副作用の器官別大分類別の発現
割合は「胃腸障害」5.7%(4/70 例)、「一般・全身障害および投与部位の状態」1.4%
(1/70 例)であったが、本調査ではそれぞれ「胃腸障害」は 3.97%(65/1,638 例)、「一
般・全身障害および投与部位の状態」は 0.37%(6/1,638 例)であり、承認時までの試験と
比較して上回っておらず、本調査で認めた副作用の発現傾向は承認時までの試験と同様で
あり、問題を認めなかった。
2.2.2. 副作用発現に影響を及ぼす要因
安全性解析対象症例における患者背景別の副作用発現割合は、表 4 の通りであった。統計
学的解析は χ2 検定又は Fisher の直接確率法にて p 値を求め、有意水準を 5%とした(「不明・
未記載」は検定から除いた)。
その結果、「合併症」の有無、「併用薬剤」の有無及び「服用期間(日)
」において、副作
用発現割合に有意な差が認められた。
8
16 / 32