よむ、つかう、まなぶ。
資料1-2 セイヨウトチノキ種子エキスのリスク評価について[4.6MB] (21 ページ)
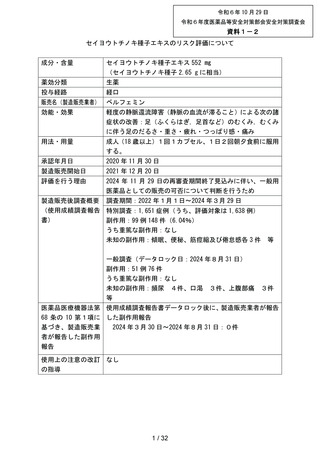
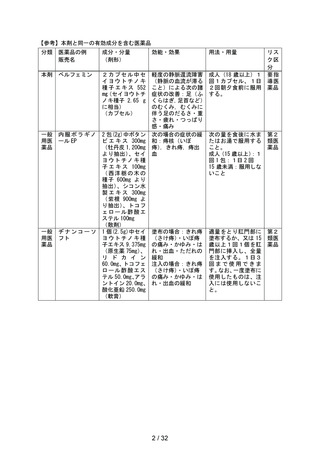
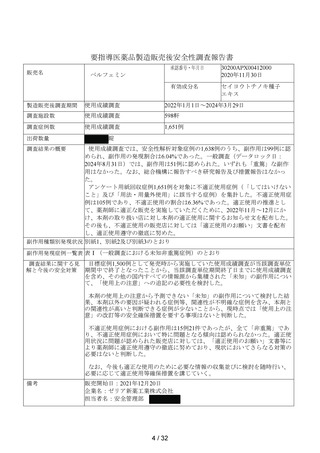
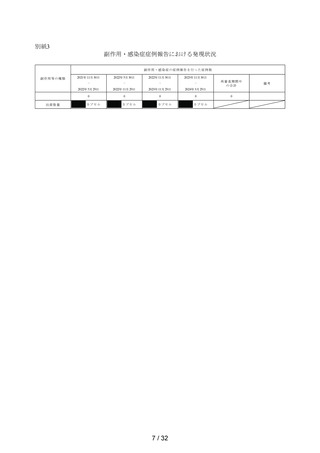
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44431.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第8回 10/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
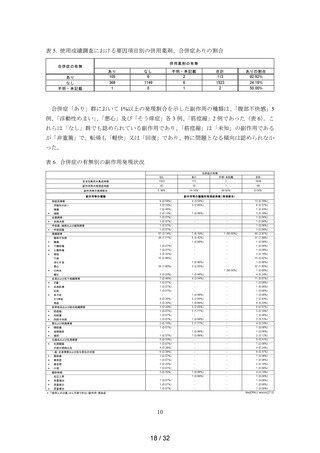
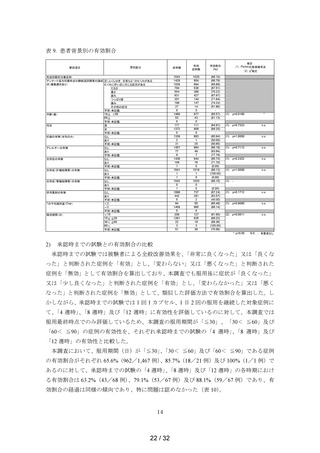
例)の順であった(表 8)。
症例数が多くかつ発現割合が高かった「<15」群における 1%以上の発現割合を示した副
作用の種類は、
「悪心」20 例(9.26%)、
「腹部不快感」17 例(7.87%)、
「頭痛」及び「下痢」
各 6 例(2.78%)、
「浮動性めまい」5 例(2.31%)及び「嘔吐」3 例(1.39%)であった。これ
らの副作用は他の区分でも認められている「既知」で「非重篤」の副作用であり、特に問題
となる傾向は認められなかった。
表 8. 服用期間(日)の区分別の副作用発現状況
服用期間(日)
安全性解析対象症例数
<15
216
15≦ ≦30
1334
30< ≦90
27
90<
3
不明・未記載
58
合計
1638
副作用等の発現症例数
49
45
1
1
3
99
副作用等の発現割合
22.69%
3.37%
3.70%
33.33%
5.17%
6.04%
副作用等の種類
9 (4.17%)
神経系障害
5 (2.31%)
浮動性めまい
6 (2.78%)
頭痛
1 (0.46%)
* 傾眠
1 (0.46%)
血管障害
1 (0.46%)
* 末梢冷感
1 (0.46%)
呼吸器、胸郭および縦隔障害
1 (0.46%)
* 呼吸困難
33 (15.28%)
胃腸障害
17
(7.87%)
腹部不快感
1 (0.46%)
* 腹痛
* 下腹部痛
* 上腹部痛
* 便秘
6
(2.78%)
下痢
1 (0.46%)
消化不良
20 (9.26%)
悪心
* 口内炎
3 (1.39%)
嘔吐
4 (1.85%)
皮膚および皮下組織障害
1 (0.46%)
* ざ瘡
1 (0.46%)
* 皮膚乾燥
1 (0.46%)
紅斑
* 多汗症
2 (0.93%)
そう痒症
2 (0.93%)
発疹
4 (1.85%)
筋骨格系および結合組織障害
2 (0.93%)
* 筋痙縮
1 (0.46%)
* 四肢痛
1 (0.46%)
* 四肢不快感
1 (0.46%)
腎および尿路障害
* 膀胱痛
1 (0.46%)
* 夜間頻尿
* 頻尿
2 (0.93%)
生殖系および乳房障害
* 乳房腫脹
2 (0.93%)
月経中間期出血
4 (1.85%)
一般・全身障害および投与部位の状態
1 (0.46%)
* 顔面痛
1 (0.46%)
* 異常感
2 (0.93%)
* 倦怠感
* 口渇
1 (0.46%)
臨床検査
血圧上昇
* 体重増加
1 (0.46%)
* 尿量減少
* 尿量増加
*:「使用上の注意」から予測できない副作用・感染症
副作用等の種類別発現症例数( 発現割合)
3 (0.22%)
1 (0.07%)
2 (0.15%)
28 (2.10%)
13 (0.97%)
1 (0.07%)
3 (0.22%)
9 (0.67%)
10 (0.75%)
1 (0.07%)
1 (0.07%)
7 (0.52%)
1 (0.07%)
5 (0.37%)
2 (0.15%)
2 (0.15%)
1 (0.07%)
1 (0.07%)
3 (0.22%)
1 (0.07%)
2 (0.15%)
3 (0.22%)
1 (0.07%)
2 (0.15%)
1 (0.07%)
1 (0.07%)
3 (0.22%)
1 (0.07%)
1 (0.07%)
1 (0.07%)
1 (3.70%)
1 (3.70%)
-
1 (33.33%)
1 (33.33%)
1 (33.33%)
1 (33.33%)
-
3 (5.17%)
1 (1.72%)
2 (3.45%)
-
13 (0.79%)
6 (0.37%)
7 (0.43%)
3 (0.18%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
65 (3.97%)
31 (1.89%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
3 (0.18%)
15 (0.92%)
1 (0.06%)
32 (1.95%)
1 (0.06%)
4 (0.24%)
11 (0.67%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
7 (0.43%)
4 (0.24%)
6 (0.37%)
3 (0.18%)
1 (0.06%)
2 (0.12%)
4 (0.24%)
1 (0.06%)
1 (0.06%)
2 (0.12%)
5 (0.31%)
1 (0.06%)
4 (0.24%)
6 (0.37%)
1 (0.06%)
1 (0.06%)
3 (0.18%)
1 (0.06%)
4 (0.24%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
MedDRA/J version(27.0)
2.3. 有効性
2.3.1. 有効割合
1)
有効割合
有効性解析対象症例 1,543 例において、服用期間後の評価が「良くなった」又は「少し良
くなった」を「有効」、
「変わらなかった」又は「悪くなった」を「無効」とし、有効割合を
算出した。その結果、有効割合は、66.10%(1,020/1,543 例)であった(表 9)。
13
21 / 32
症例数が多くかつ発現割合が高かった「<15」群における 1%以上の発現割合を示した副
作用の種類は、
「悪心」20 例(9.26%)、
「腹部不快感」17 例(7.87%)、
「頭痛」及び「下痢」
各 6 例(2.78%)、
「浮動性めまい」5 例(2.31%)及び「嘔吐」3 例(1.39%)であった。これ
らの副作用は他の区分でも認められている「既知」で「非重篤」の副作用であり、特に問題
となる傾向は認められなかった。
表 8. 服用期間(日)の区分別の副作用発現状況
服用期間(日)
安全性解析対象症例数
<15
216
15≦ ≦30
1334
30< ≦90
27
90<
3
不明・未記載
58
合計
1638
副作用等の発現症例数
49
45
1
1
3
99
副作用等の発現割合
22.69%
3.37%
3.70%
33.33%
5.17%
6.04%
副作用等の種類
9 (4.17%)
神経系障害
5 (2.31%)
浮動性めまい
6 (2.78%)
頭痛
1 (0.46%)
* 傾眠
1 (0.46%)
血管障害
1 (0.46%)
* 末梢冷感
1 (0.46%)
呼吸器、胸郭および縦隔障害
1 (0.46%)
* 呼吸困難
33 (15.28%)
胃腸障害
17
(7.87%)
腹部不快感
1 (0.46%)
* 腹痛
* 下腹部痛
* 上腹部痛
* 便秘
6
(2.78%)
下痢
1 (0.46%)
消化不良
20 (9.26%)
悪心
* 口内炎
3 (1.39%)
嘔吐
4 (1.85%)
皮膚および皮下組織障害
1 (0.46%)
* ざ瘡
1 (0.46%)
* 皮膚乾燥
1 (0.46%)
紅斑
* 多汗症
2 (0.93%)
そう痒症
2 (0.93%)
発疹
4 (1.85%)
筋骨格系および結合組織障害
2 (0.93%)
* 筋痙縮
1 (0.46%)
* 四肢痛
1 (0.46%)
* 四肢不快感
1 (0.46%)
腎および尿路障害
* 膀胱痛
1 (0.46%)
* 夜間頻尿
* 頻尿
2 (0.93%)
生殖系および乳房障害
* 乳房腫脹
2 (0.93%)
月経中間期出血
4 (1.85%)
一般・全身障害および投与部位の状態
1 (0.46%)
* 顔面痛
1 (0.46%)
* 異常感
2 (0.93%)
* 倦怠感
* 口渇
1 (0.46%)
臨床検査
血圧上昇
* 体重増加
1 (0.46%)
* 尿量減少
* 尿量増加
*:「使用上の注意」から予測できない副作用・感染症
副作用等の種類別発現症例数( 発現割合)
3 (0.22%)
1 (0.07%)
2 (0.15%)
28 (2.10%)
13 (0.97%)
1 (0.07%)
3 (0.22%)
9 (0.67%)
10 (0.75%)
1 (0.07%)
1 (0.07%)
7 (0.52%)
1 (0.07%)
5 (0.37%)
2 (0.15%)
2 (0.15%)
1 (0.07%)
1 (0.07%)
3 (0.22%)
1 (0.07%)
2 (0.15%)
3 (0.22%)
1 (0.07%)
2 (0.15%)
1 (0.07%)
1 (0.07%)
3 (0.22%)
1 (0.07%)
1 (0.07%)
1 (0.07%)
1 (3.70%)
1 (3.70%)
-
1 (33.33%)
1 (33.33%)
1 (33.33%)
1 (33.33%)
-
3 (5.17%)
1 (1.72%)
2 (3.45%)
-
13 (0.79%)
6 (0.37%)
7 (0.43%)
3 (0.18%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
65 (3.97%)
31 (1.89%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
3 (0.18%)
15 (0.92%)
1 (0.06%)
32 (1.95%)
1 (0.06%)
4 (0.24%)
11 (0.67%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
7 (0.43%)
4 (0.24%)
6 (0.37%)
3 (0.18%)
1 (0.06%)
2 (0.12%)
4 (0.24%)
1 (0.06%)
1 (0.06%)
2 (0.12%)
5 (0.31%)
1 (0.06%)
4 (0.24%)
6 (0.37%)
1 (0.06%)
1 (0.06%)
3 (0.18%)
1 (0.06%)
4 (0.24%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
1 (0.06%)
MedDRA/J version(27.0)
2.3. 有効性
2.3.1. 有効割合
1)
有効割合
有効性解析対象症例 1,543 例において、服用期間後の評価が「良くなった」又は「少し良
くなった」を「有効」、
「変わらなかった」又は「悪くなった」を「無効」とし、有効割合を
算出した。その結果、有効割合は、66.10%(1,020/1,543 例)であった(表 9)。
13
21 / 32