よむ、つかう、まなぶ。
資料1-8 副反応疑い報告の状況について (79 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00043.html |
| 出典情報 | 第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第5回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(6/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
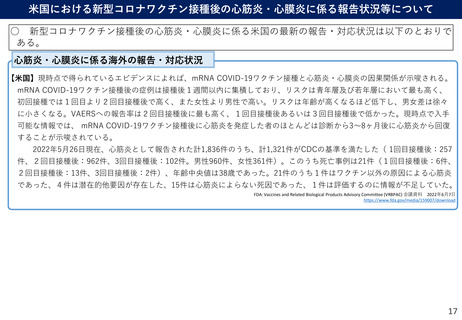
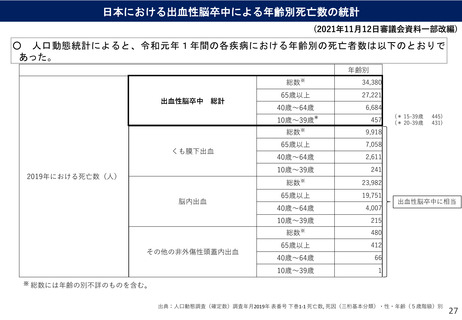
ノババックス社ワクチンの諸外国における副反応疑いの報告状況について
○
ノババックス社のワクチンに係る副反応疑いの報告状況について、海外当局からは、以下の情報が
公表されている。
カナダ
EU
副反応疑い
報告件数
報告された
主な
副反応疑い
の症状
安全性に関
する評価
出典
オーストラリア
294件(約17.8万回接種時点)
→約1,652件/100万回接種相当
(2022年4月24日時点)
不明
726件(約146,300 回接種時点)
→約4,958件/100万回接種相当
(2022年5月29日時点)
治験において、
• 頭痛、吐き気または嘔吐、筋肉痛や関
節痛、注射部位の圧痛や痛み、疲労、
倦怠感など、10人に1人以上の割合で発
生。
• 注射部位の発赤・腫脹、発熱、悪寒、
手足の痛みなど、10人に1人未満の割合
で発生。
• リンパ節の腫脹、高血圧、発疹、皮膚
の発赤、注射部位の掻痒・発疹などは、
100人に1人未満の割合で発生。
市販後において、
• 死亡例は報告されていない(2022年4月
24日時点)。
「可能性がある副反応」の項において、
ワクチンの一般的な副反応として
• 注射部位に発赤、疼痛、腫脹等の症状
が現れることがある。
• その他の症状として悪寒、疲労、関節
痛、頭痛、微熱、筋肉痛、吐き気と嘔
吐が発生することがある。
ワクチンの稀な副反応として
• 重篤なアレルギー反応(アナフィラキ
シー)が稀にある。
との記載あり。
市販後において、
• 胸痛、頭痛、倦怠感、知覚異常、めま
い等が発生。
• 心筋炎・心膜炎疑い事例が少数報告さ
れたが、国際基準に従って評価した結
果、心筋炎疑い事例は3件、心膜炎疑い
事例が11件であった。
治験において、
• 副作用のほとんどは軽度から中等度で
あり、数日以内に消失する。そのため、
接種のベネフィットがリスクを上回り、
EUでの認可を推奨できると判断された。
• 記載なし
• 記載なし
COVID-19 vaccines safety update
Novavax Nuvaxovid COVID-19 vaccine
2022年5月12日欧州医薬品庁(EMA)
2022年3月31日カナダ政府
COVID-19 vaccine weekly safety report - 2-062022
https://www.ema.europa.eu/en/medicines/human/EPAR/nuva
xovid#safety-updates-section
https://www.canada.ca/en/health-canada/services/drugshealth-products/covid19-industry/drugs-vaccinestreatments/vaccines/novavax.html
Nuvaxovid :EPAR Medecine Overview
2022年3月7日欧州医薬品庁(EMA)
2022年6月2日オーストラリア医薬製品管理局
https://www.tga.gov.au/periodic/covid-19-vaccineweekly-safety-report-02-06-2022
https://www.ema.europa.eu/en/documents/overview/nuvaxov
id-epar-medicine-overview_en.pdf
79
○
ノババックス社のワクチンに係る副反応疑いの報告状況について、海外当局からは、以下の情報が
公表されている。
カナダ
EU
副反応疑い
報告件数
報告された
主な
副反応疑い
の症状
安全性に関
する評価
出典
オーストラリア
294件(約17.8万回接種時点)
→約1,652件/100万回接種相当
(2022年4月24日時点)
不明
726件(約146,300 回接種時点)
→約4,958件/100万回接種相当
(2022年5月29日時点)
治験において、
• 頭痛、吐き気または嘔吐、筋肉痛や関
節痛、注射部位の圧痛や痛み、疲労、
倦怠感など、10人に1人以上の割合で発
生。
• 注射部位の発赤・腫脹、発熱、悪寒、
手足の痛みなど、10人に1人未満の割合
で発生。
• リンパ節の腫脹、高血圧、発疹、皮膚
の発赤、注射部位の掻痒・発疹などは、
100人に1人未満の割合で発生。
市販後において、
• 死亡例は報告されていない(2022年4月
24日時点)。
「可能性がある副反応」の項において、
ワクチンの一般的な副反応として
• 注射部位に発赤、疼痛、腫脹等の症状
が現れることがある。
• その他の症状として悪寒、疲労、関節
痛、頭痛、微熱、筋肉痛、吐き気と嘔
吐が発生することがある。
ワクチンの稀な副反応として
• 重篤なアレルギー反応(アナフィラキ
シー)が稀にある。
との記載あり。
市販後において、
• 胸痛、頭痛、倦怠感、知覚異常、めま
い等が発生。
• 心筋炎・心膜炎疑い事例が少数報告さ
れたが、国際基準に従って評価した結
果、心筋炎疑い事例は3件、心膜炎疑い
事例が11件であった。
治験において、
• 副作用のほとんどは軽度から中等度で
あり、数日以内に消失する。そのため、
接種のベネフィットがリスクを上回り、
EUでの認可を推奨できると判断された。
• 記載なし
• 記載なし
COVID-19 vaccines safety update
Novavax Nuvaxovid COVID-19 vaccine
2022年5月12日欧州医薬品庁(EMA)
2022年3月31日カナダ政府
COVID-19 vaccine weekly safety report - 2-062022
https://www.ema.europa.eu/en/medicines/human/EPAR/nuva
xovid#safety-updates-section
https://www.canada.ca/en/health-canada/services/drugshealth-products/covid19-industry/drugs-vaccinestreatments/vaccines/novavax.html
Nuvaxovid :EPAR Medecine Overview
2022年3月7日欧州医薬品庁(EMA)
2022年6月2日オーストラリア医薬製品管理局
https://www.tga.gov.au/periodic/covid-19-vaccineweekly-safety-report-02-06-2022
https://www.ema.europa.eu/en/documents/overview/nuvaxov
id-epar-medicine-overview_en.pdf
79