よむ、つかう、まなぶ。
【資料1】 これまでの意見及び論点案について (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28536.html |
| 出典情報 | 医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会(第3回 10/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
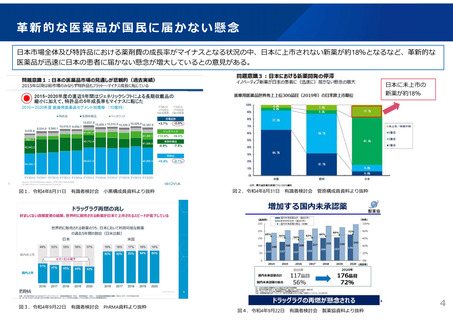
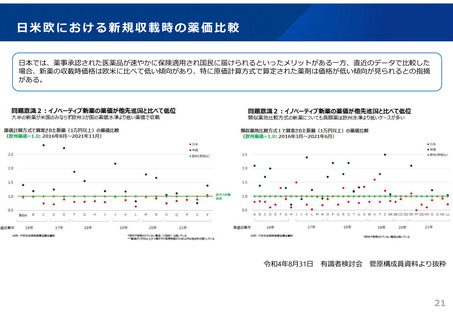
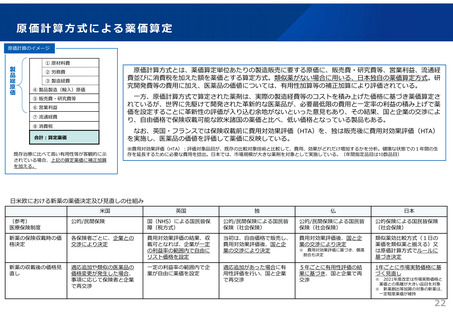
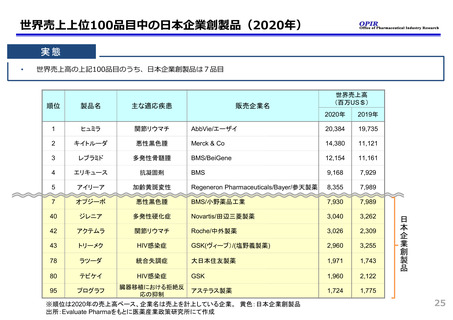
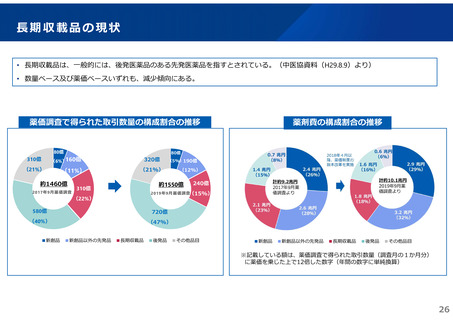
革新的な医薬品の迅速な導入について
③その他の要因に係る課題
主な意見等
○
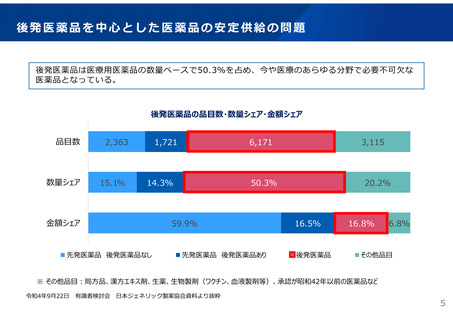
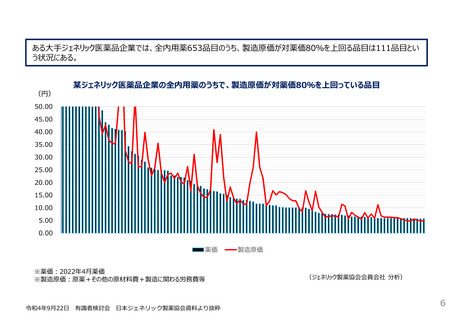
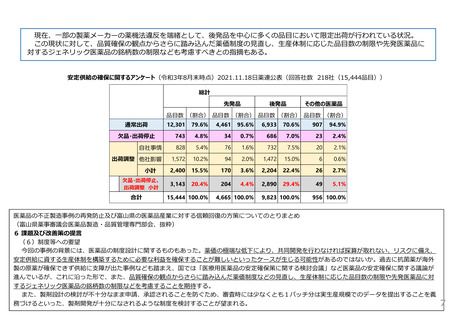
革新的な医薬品の迅速な導入に関して、薬価や産業構造に関するもののほか、以下の意見があった。
•
国内未承認薬の増加については、薬価や市場規模の問題だけでなく、薬事制度や臨床試験等の開発環境にも原因があるのではな
いか。
•
薬事制度上の課題としては、承認申請資料が日本語であること、日本人データを要求されること、治験環境については、施設の
集約状況が異なるためコスト・スピード面で海外より劣っているなどの課題がある。
•
日本の先駆的医薬品指定制度は、米国のBreakthrough Therapy制度や欧州のPRIME制度と比較して、指定要件やプロセスの観
点から利用を躊躇するケースが多く、指定数が大幅に少ない。
•
国内企業の産業育成は、薬価制度ではなく、ベンチャーの育成、産学協同、税制等の別の施策で対応するべき。
31
③その他の要因に係る課題
主な意見等
○
革新的な医薬品の迅速な導入に関して、薬価や産業構造に関するもののほか、以下の意見があった。
•
国内未承認薬の増加については、薬価や市場規模の問題だけでなく、薬事制度や臨床試験等の開発環境にも原因があるのではな
いか。
•
薬事制度上の課題としては、承認申請資料が日本語であること、日本人データを要求されること、治験環境については、施設の
集約状況が異なるためコスト・スピード面で海外より劣っているなどの課題がある。
•
日本の先駆的医薬品指定制度は、米国のBreakthrough Therapy制度や欧州のPRIME制度と比較して、指定要件やプロセスの観
点から利用を躊躇するケースが多く、指定数が大幅に少ない。
•
国内企業の産業育成は、薬価制度ではなく、ベンチャーの育成、産学協同、税制等の別の施策で対応するべき。
31