よむ、つかう、まなぶ。
【資料1】 これまでの意見及び論点案について (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28536.html |
| 出典情報 | 医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会(第3回 10/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
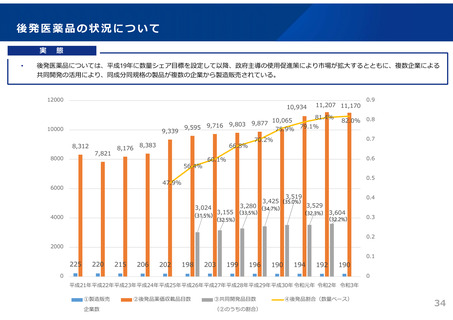
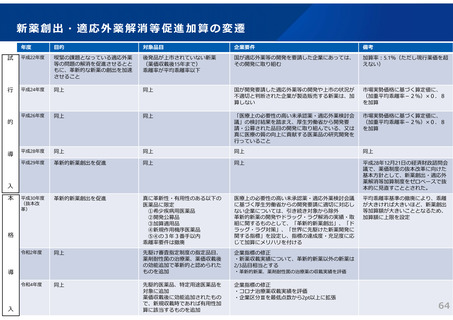
(参考)後発医薬品の共同開発
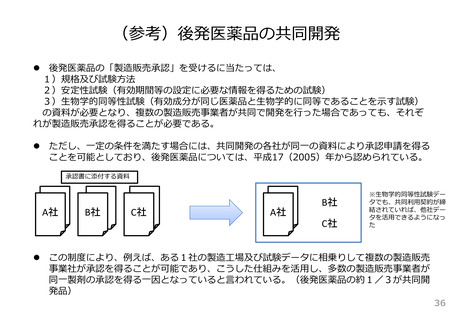
後発医薬品の「製造販売承認」を受けるに当たっては、
1)規格及び試験方法
2)安定性試験(有効期間等の設定に必要な情報を得るための試験)
3)生物学的同等性試験(有効成分が同じ医薬品と生物学的に同等であることを示す試験)
の資料が必要となり、複数の製造販売事業者が共同で開発を行った場合であっても、それぞ
れが製造販売承認を得ることが必要である。
ただし、一定の条件を満たす場合には、共同開発の各社が同一の資料により承認申請を得る
ことを可能としており、後発医薬品については、平成17(2005)年から認められている。
承認書に添付する資料
A社
B社
C社
A社
B社
C社
※生物学的同等性試験デー
タでも、共同利用契約が締
結されていれば、他社デー
タを活用できるようになっ
た
この制度により、例えば、ある1社の製造工場及び試験データに相乗りして複数の製造販売
事業社が承認を得ることが可能であり、こうした仕組みを活用し、多数の製造販売事業者が
同一製剤の承認を得る一因となっていると言われている。(後発医薬品の約1/3が共同開
発品)
36
後発医薬品の「製造販売承認」を受けるに当たっては、
1)規格及び試験方法
2)安定性試験(有効期間等の設定に必要な情報を得るための試験)
3)生物学的同等性試験(有効成分が同じ医薬品と生物学的に同等であることを示す試験)
の資料が必要となり、複数の製造販売事業者が共同で開発を行った場合であっても、それぞ
れが製造販売承認を得ることが必要である。
ただし、一定の条件を満たす場合には、共同開発の各社が同一の資料により承認申請を得る
ことを可能としており、後発医薬品については、平成17(2005)年から認められている。
承認書に添付する資料
A社
B社
C社
A社
B社
C社
※生物学的同等性試験デー
タでも、共同利用契約が締
結されていれば、他社デー
タを活用できるようになっ
た
この制度により、例えば、ある1社の製造工場及び試験データに相乗りして複数の製造販売
事業社が承認を得ることが可能であり、こうした仕組みを活用し、多数の製造販売事業者が
同一製剤の承認を得る一因となっていると言われている。(後発医薬品の約1/3が共同開
発品)
36