よむ、つかう、まなぶ。
資料1-3-2 新型コロナワクチン接種後の死亡として報告された事例の概要(スパイクバックス筋注) (44 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00059.html |
| 出典情報 | 第92回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第27回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
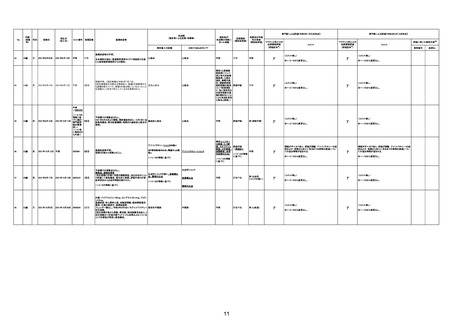
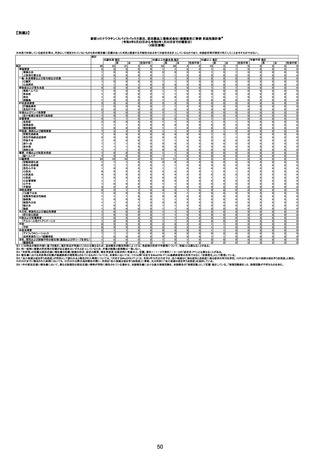
No
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
ロット番号
接種回数
死因等
(報告者による見解・考察等)
基礎疾患等
報告書上の記載
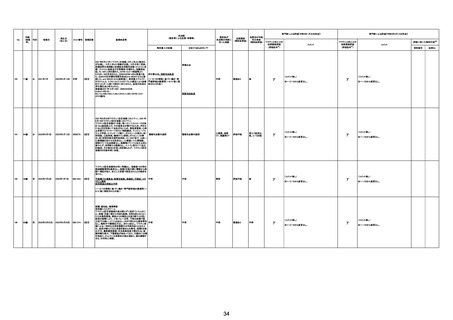
215
216
52歳
85歳
女
男
2022年7月21日
2022年3月16日
2022年8月13日
3003656
2022年12月31日 3006327
不明
3回目
既往症:胃痛
死亡2ヶ月前から胃痛あるも、定期通院等なし。飲酒しな
心不全、溺死
がら入浴し、溺没して発見。死後27時間で行政解剖→死
因に、虚血性心不全に基づく溺水。
ワクチン後7日目から力が入らない。動機、息切れ発生。
その後も動くとなんともいえない胸の不快感が続く。
XP,CT,血液検査で明らかな原因不明。R4.8月以後受診
しなくなる。(この間体重6キロ減)12月末食事が取れなく
不明
なったと受診。(さらに体重5.6キロ減)。誤嚥性肺炎の治
療を開始するも5日後死亡。COPDなどの報告あり。原因
がよくわからない。全身状態の悪化、体重減少死亡事例
なので報告。
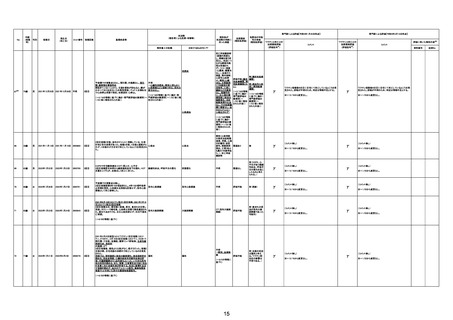
専門家による評価【令和5年1月20日時点】
報告医が
死因等の判断に
至った検査
因果関係
(報告医評価)
他要因の可能
性の有無
(報告医評価)
対応するMedDRA PT
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
専門家による評価【令和5年3月10日時点】
評価に用いた報告内容注2
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
資料番号
症例No
心不全
部検
評価不能
有(虚血性心不
全)
-
-
γ
(コメント無し)
資料1-2-2-4 26170
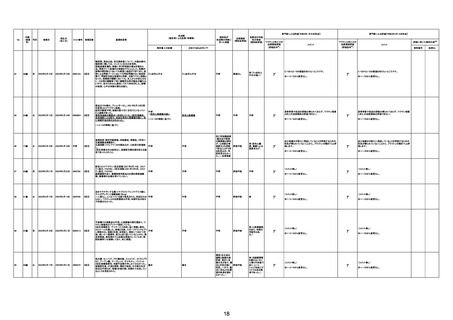
不明
不明
関連あり
不明
-
-
γ
(コメント無し)
資料1-2-2-4 26172
不明
不明
評価不能
有(右尿管狭
窄、腎盂腎炎の
疑い)
-
-
γ
情報少ない
資料1-1-2-4 35835
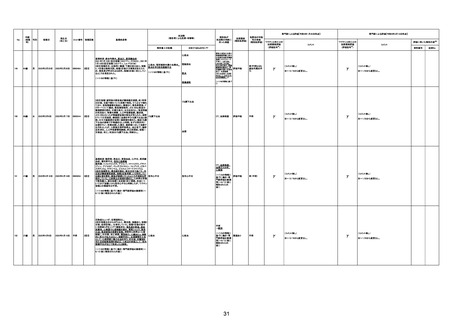
溺死
基礎疾患等:多発性皮膚筋炎、椎間板ヘルニア、虫垂
癌術後
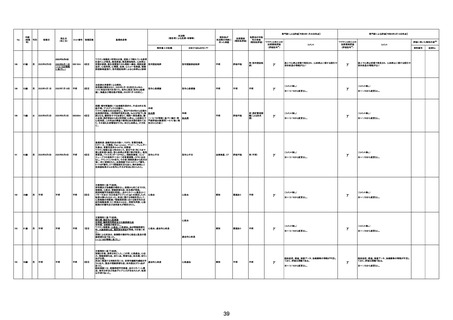
217
72歳
女
2023年1月12日
2023年1月14日
不明
4回目
2023/1/12 コロナウィルス感染症ワクチン接種。夕頃か
ら下腹部痛や具合の悪さを訴える。家族(妹)訪問。顔色
不良だったが、コロナウィルス感染症ワクチン接種後副 敗血症、意識障害
反応と考え様子を見ていた。
2023/1/13 AM、妹さん再訪し、意識障害および顔色不
良著明でHP搬送。敗血症性ショック(右尿管狭窄及び右
腎周囲脂肪織濃度の上昇あり)DICの診断で病院搬送さ
れ、集中治療も1/14AM1:08死亡確認。
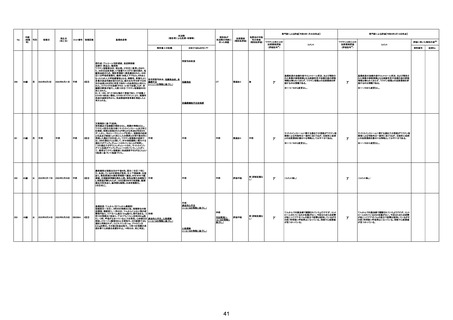
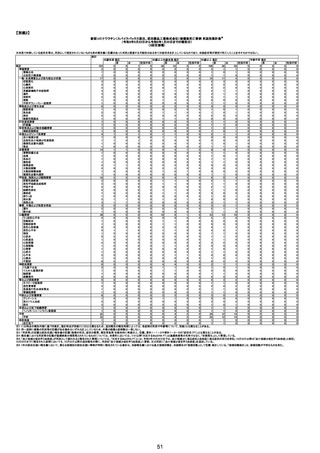
注1:各症例の記載は、令和3年5月22日~令和4年11月13日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年11月13日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注4:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1-1-2や資料1-2-2の「症状名(PT)」とは異なることがある。
注5:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注6:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
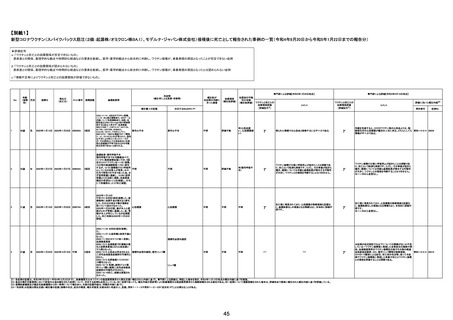
注7:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。
注8:接種医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:搬送医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
44
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
ロット番号
接種回数
死因等
(報告者による見解・考察等)
基礎疾患等
報告書上の記載
215
216
52歳
85歳
女
男
2022年7月21日
2022年3月16日
2022年8月13日
3003656
2022年12月31日 3006327
不明
3回目
既往症:胃痛
死亡2ヶ月前から胃痛あるも、定期通院等なし。飲酒しな
心不全、溺死
がら入浴し、溺没して発見。死後27時間で行政解剖→死
因に、虚血性心不全に基づく溺水。
ワクチン後7日目から力が入らない。動機、息切れ発生。
その後も動くとなんともいえない胸の不快感が続く。
XP,CT,血液検査で明らかな原因不明。R4.8月以後受診
しなくなる。(この間体重6キロ減)12月末食事が取れなく
不明
なったと受診。(さらに体重5.6キロ減)。誤嚥性肺炎の治
療を開始するも5日後死亡。COPDなどの報告あり。原因
がよくわからない。全身状態の悪化、体重減少死亡事例
なので報告。
専門家による評価【令和5年1月20日時点】
報告医が
死因等の判断に
至った検査
因果関係
(報告医評価)
他要因の可能
性の有無
(報告医評価)
対応するMedDRA PT
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
専門家による評価【令和5年3月10日時点】
評価に用いた報告内容注2
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
資料番号
症例No
心不全
部検
評価不能
有(虚血性心不
全)
-
-
γ
(コメント無し)
資料1-2-2-4 26170
不明
不明
関連あり
不明
-
-
γ
(コメント無し)
資料1-2-2-4 26172
不明
不明
評価不能
有(右尿管狭
窄、腎盂腎炎の
疑い)
-
-
γ
情報少ない
資料1-1-2-4 35835
溺死
基礎疾患等:多発性皮膚筋炎、椎間板ヘルニア、虫垂
癌術後
217
72歳
女
2023年1月12日
2023年1月14日
不明
4回目
2023/1/12 コロナウィルス感染症ワクチン接種。夕頃か
ら下腹部痛や具合の悪さを訴える。家族(妹)訪問。顔色
不良だったが、コロナウィルス感染症ワクチン接種後副 敗血症、意識障害
反応と考え様子を見ていた。
2023/1/13 AM、妹さん再訪し、意識障害および顔色不
良著明でHP搬送。敗血症性ショック(右尿管狭窄及び右
腎周囲脂肪織濃度の上昇あり)DICの診断で病院搬送さ
れ、集中治療も1/14AM1:08死亡確認。
注1:各症例の記載は、令和3年5月22日~令和4年11月13日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年11月13日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注4:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1-1-2や資料1-2-2の「症状名(PT)」とは異なることがある。
注5:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注6:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注7:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。
注8:接種医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:搬送医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
44