よむ、つかう、まなぶ。
資料2-7-1 「緊急安全性情報等の提供に関する指針について」の一部改正について[4.6MB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
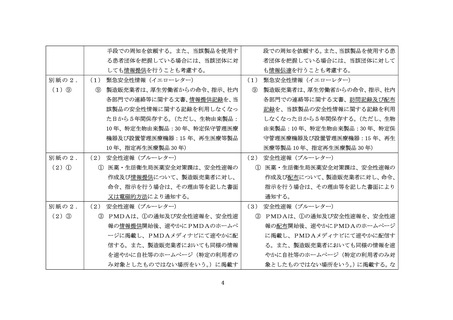
別紙様式 8
へ
RS
改訂
改訂前
(別紙様式 8 )
安全性速報の提供報告書
独立行政法人医薬品医療機器総合機構医薬品安全対策第一部長 又は
独立行政法人医薬品医療機器総合機構医療機器品質管理・安全対策部長 殿
住所 (法人にあっては主たる事務所の所在地)
氏名 (法人にあっては名称及び代表者の氏名)
担当者連絡先
(電話)
令和 年 月 日付 薬生安発 第 号をもって指示のあった下記の医療機器再生医療等
製品にかかる安全性速報を提供いたしましたので決のとおり報告します。
(報告内容)
1. 医療機器再生医療等製品
1 ) 販売名
2) 一般的名称
2. 安全性速報の提供状況
1) 医療機関・薬局等に対する提供状況
(1) 提供方法
(2) 提供医療機関・薬局等の救
(3) 提供開始日
(4) 提供終了日
2) 国民 (恵者) への提供状況(実施した場合)
(1) 提供方法
(2) 提供医療機関・楽局等の数
3) 自社等のホームページ (URL) への掲載日
4 ) PMDA メディナビによる配信日
5) その他
3. 回収等の措置 (製品の回収等を伴う場合
1 ) 回収等を行った数量 (最終製品数)
2) 回収等の方法
3 ) 回収等の開始日
4 ) 回収等の終了目
5) 回収等を行った製品の処理状況
(備考) 報告書には次のものを添付すること。
1 ) 安全性速報
2) 安全性速報 (国民 (患者) 向け) (実施した場合)
(別紙様式 8 )
安全性速報配布 (等) 報告書
令和 年 。 月 日
独立行政法人医薬品医療機器総合機構医薬品安全対策第二部長 又は
独立行政法人医薬品医療機器総合機構医療機器品質管理・安全対策部長 殿
住所 (法人にあっては主たる事務所の所在地)
氏名 (ま人にあっては名称及び代表者の氏名)
印
担当者連絡先
(電話)
令和 年 月 日付 薬生安発 第 号をもって指示のあった下記の医療機器再生医療等
製品にかかる安全性速報を配布 (等) いたしましたので次のとおり報告 します。
(報告内容)
1. 医療機器再生医療等製品
1 ) 販売名
2 ) 一般的名称
2. 安全性速報の配布状況
1) 医療機関・薬局等に対する配布状況
(1) 配布方法
(2 ) 配布医療機関・薬局等の数
(3) 配布部数
(4) 配布開始日
(5) 配布終了日
2) 国民 (上恵者) への提供状況 (実施した場合)
(1) 提供方法
(2) 提供医療機関・薬局等の数
(3) 提供部数
3) 電子媒体等による情報提供状況
(1) 自社等のホームページ (URL) への掲載日
(2) PMDA メディナビによる配信日
(3) その他
3. 回収等の措置 (製品の回収等を伴う場合)
1 ) 回収等を行った数量 (最終製品数)
2) 回収等の旋法
3) 回収等の開始日
4) 回収等の終了日
5) 回収等を行った製品の処理状況
(備考) 報告書には次のものを添付すること。
1 ) 安全性速報
2 ) 安全性速報 (国民 (患者) 向け) (実施した場合)
16
へ
RS
改訂
改訂前
(別紙様式 8 )
安全性速報の提供報告書
独立行政法人医薬品医療機器総合機構医薬品安全対策第一部長 又は
独立行政法人医薬品医療機器総合機構医療機器品質管理・安全対策部長 殿
住所 (法人にあっては主たる事務所の所在地)
氏名 (法人にあっては名称及び代表者の氏名)
担当者連絡先
(電話)
令和 年 月 日付 薬生安発 第 号をもって指示のあった下記の医療機器再生医療等
製品にかかる安全性速報を提供いたしましたので決のとおり報告します。
(報告内容)
1. 医療機器再生医療等製品
1 ) 販売名
2) 一般的名称
2. 安全性速報の提供状況
1) 医療機関・薬局等に対する提供状況
(1) 提供方法
(2) 提供医療機関・薬局等の救
(3) 提供開始日
(4) 提供終了日
2) 国民 (恵者) への提供状況(実施した場合)
(1) 提供方法
(2) 提供医療機関・楽局等の数
3) 自社等のホームページ (URL) への掲載日
4 ) PMDA メディナビによる配信日
5) その他
3. 回収等の措置 (製品の回収等を伴う場合
1 ) 回収等を行った数量 (最終製品数)
2) 回収等の方法
3 ) 回収等の開始日
4 ) 回収等の終了目
5) 回収等を行った製品の処理状況
(備考) 報告書には次のものを添付すること。
1 ) 安全性速報
2) 安全性速報 (国民 (患者) 向け) (実施した場合)
(別紙様式 8 )
安全性速報配布 (等) 報告書
令和 年 。 月 日
独立行政法人医薬品医療機器総合機構医薬品安全対策第二部長 又は
独立行政法人医薬品医療機器総合機構医療機器品質管理・安全対策部長 殿
住所 (法人にあっては主たる事務所の所在地)
氏名 (ま人にあっては名称及び代表者の氏名)
印
担当者連絡先
(電話)
令和 年 月 日付 薬生安発 第 号をもって指示のあった下記の医療機器再生医療等
製品にかかる安全性速報を配布 (等) いたしましたので次のとおり報告 します。
(報告内容)
1. 医療機器再生医療等製品
1 ) 販売名
2 ) 一般的名称
2. 安全性速報の配布状況
1) 医療機関・薬局等に対する配布状況
(1) 配布方法
(2 ) 配布医療機関・薬局等の数
(3) 配布部数
(4) 配布開始日
(5) 配布終了日
2) 国民 (上恵者) への提供状況 (実施した場合)
(1) 提供方法
(2) 提供医療機関・薬局等の数
(3) 提供部数
3) 電子媒体等による情報提供状況
(1) 自社等のホームページ (URL) への掲載日
(2) PMDA メディナビによる配信日
(3) その他
3. 回収等の措置 (製品の回収等を伴う場合)
1 ) 回収等を行った数量 (最終製品数)
2) 回収等の旋法
3) 回収等の開始日
4) 回収等の終了日
5) 回収等を行った製品の処理状況
(備考) 報告書には次のものを添付すること。
1 ) 安全性速報
2 ) 安全性速報 (国民 (患者) 向け) (実施した場合)
16