よむ、つかう、まなぶ。
資料2-7-1 「緊急安全性情報等の提供に関する指針について」の一部改正について[4.6MB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
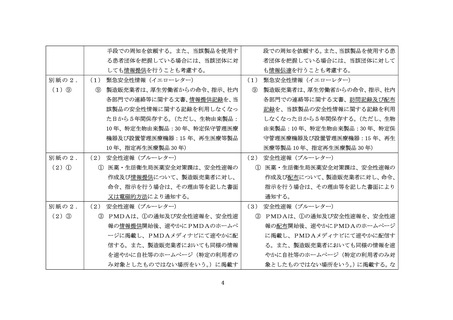
(別紙)
緊急安全性情報等の提供に関する指針
1.
緊急安全性情報等の作成基準
(1)緊急安全性情報(イエローレター)
① 医薬品等について、
(ア)に掲げるいずれかの状況からみて、国民(患者)、医薬
関係者に対して緊急かつ重大な注意喚起や使用制限に係る対策が必要な状況に
ある場合に、
(イ)に掲げる措置を実施するに当たって、厚生労働省からの命令、
指示、製造販売業者の自主的な決定その他により作成する。
(ア)項
・ 法第 68 条の 10 に基づく副作用・不具合等の報告における死亡、障害若
しくはこれらにつながるおそれのある症例又は治療の困難な症例の発生
状況
・ 未知重篤な副作用・不具合等の発現など安全性上の問題が有効性に比し
て顕著である等の新たな知見
・ 外国における緊急かつ重大な安全性に関する行政措置の実施
・ 緊急安全性情報又は安全性速報等による対策によってもなお効果が十分
でないと評価された安全性上の問題
(イ)項
・ 警告欄の新設又は警告事項の追加
・ 禁忌事項若しくは禁忌・禁止事項の新設又は追加
・ 新たな安全対策の実施(検査の実施等)を伴う使用上の注意の改訂
・ 安全性上の理由による効能効果、使用目的、性能、用法用量、使用方法
等の変更
・ 安全性上の理由により、回収を伴った行政措置(販売中止、販売停止、
承認取消し)
・ その他、当該副作用・不具合等の発現防止、早期発見等のための具体的
な対策
② 緊急安全性情報は、別紙1(医薬関係者向け)の様式とし、製造販売業者の自主
的な決定であっても、製造販売業者が厚生労働省及び独立行政法人医薬品医療
機器総合機構(以下「PMDA」という。)と協議し作成する。また、医薬関係
者向けのみならず、原則として国民(患者)向け情報も別紙2(国民(患者)向
け)の様式を参考とし、あわせて作成する。
(2)安全性速報(ブルーレター)
① 保健衛生上の危害発生・拡大の防止のため、緊急安全性情報に準じ、医薬関係者
に対して一般的な使用上の注意の改訂情報よりも迅速な注意喚起や適正使用の
ための対応(注意の周知及び徹底、臨床検査の実施等の対応)の注意喚起が必要
緊急安全性情報等の提供に関する指針
1.
緊急安全性情報等の作成基準
(1)緊急安全性情報(イエローレター)
① 医薬品等について、
(ア)に掲げるいずれかの状況からみて、国民(患者)、医薬
関係者に対して緊急かつ重大な注意喚起や使用制限に係る対策が必要な状況に
ある場合に、
(イ)に掲げる措置を実施するに当たって、厚生労働省からの命令、
指示、製造販売業者の自主的な決定その他により作成する。
(ア)項
・ 法第 68 条の 10 に基づく副作用・不具合等の報告における死亡、障害若
しくはこれらにつながるおそれのある症例又は治療の困難な症例の発生
状況
・ 未知重篤な副作用・不具合等の発現など安全性上の問題が有効性に比し
て顕著である等の新たな知見
・ 外国における緊急かつ重大な安全性に関する行政措置の実施
・ 緊急安全性情報又は安全性速報等による対策によってもなお効果が十分
でないと評価された安全性上の問題
(イ)項
・ 警告欄の新設又は警告事項の追加
・ 禁忌事項若しくは禁忌・禁止事項の新設又は追加
・ 新たな安全対策の実施(検査の実施等)を伴う使用上の注意の改訂
・ 安全性上の理由による効能効果、使用目的、性能、用法用量、使用方法
等の変更
・ 安全性上の理由により、回収を伴った行政措置(販売中止、販売停止、
承認取消し)
・ その他、当該副作用・不具合等の発現防止、早期発見等のための具体的
な対策
② 緊急安全性情報は、別紙1(医薬関係者向け)の様式とし、製造販売業者の自主
的な決定であっても、製造販売業者が厚生労働省及び独立行政法人医薬品医療
機器総合機構(以下「PMDA」という。)と協議し作成する。また、医薬関係
者向けのみならず、原則として国民(患者)向け情報も別紙2(国民(患者)向
け)の様式を参考とし、あわせて作成する。
(2)安全性速報(ブルーレター)
① 保健衛生上の危害発生・拡大の防止のため、緊急安全性情報に準じ、医薬関係者
に対して一般的な使用上の注意の改訂情報よりも迅速な注意喚起や適正使用の
ための対応(注意の周知及び徹底、臨床検査の実施等の対応)の注意喚起が必要