よむ、つかう、まなぶ。
資料2-7-1 「緊急安全性情報等の提供に関する指針について」の一部改正について[4.6MB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
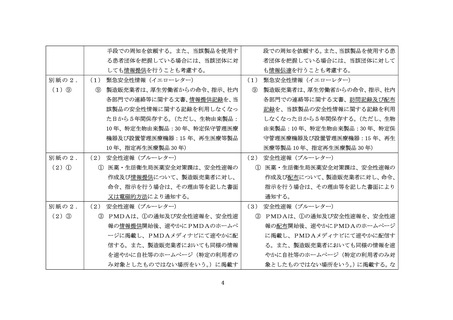
部署(医療安全管理者、医薬品安全管理責任者、医療機器安全管理責任者、又は
医療機関の製品情報担当者等の所属する部署)、薬局等に、①の通知日又は製造
販売業者が自主的に情報提供を行うと決定した日から1か月以内に情報が到着
していることを確認する。
⑦ 製造販売業者は、PMDA安全部門(医薬品及び再生医療等製品は医薬品安全対
策第一部又は医薬品安全対策第二部、医療機器は医療機器品質管理・安全対策部
をいう。以下同じ。)と緊急安全性情報の情報提供計画について事前に協議し、
別紙様式1又は別紙様式2の提供計画書をPMDA安全部門に提出する。医療
機関、薬局等への情報提供については、当該情報提供計画に従い実施し、その結
果を別紙様式3又は別紙様式4により、PMDA安全部門に提出する。
⑧ 製造販売業者は、医学、薬学等の関係団体に対して情報提供を行い、会員等への
情報提供の協力及び関係団体のホームページ等への掲載等の効果的な広報手段
での周知を依頼する。また、当該製品を使用する患者団体を把握している場合に
は、当該団体に対しても情報提供を行うことも考慮する。
⑨ 製造販売業者は、厚生労働省からの命令、指示、社内各部門での連絡等に関する
文書、情報提供記録を、当該製品の安全性情報に関する記録を利用しなくなった
日から5年間保存する。
(ただし、生物由来製品:10 年、特定生物由来製品:30
年、特定保守管理医療機器及び設置管理医療機器:15 年、再生医療等製品 10 年、
指定再生医療製品 30 年)
(2)安全性速報(ブルーレター)
① 医薬・生活衛生局医薬安全対策課は、安全性速報の作成及び情報提供について、
製造販売業者に対し、命令、指示を行う場合は、その理由等を記した書面又は電
磁的方法により通知する。
② 製造販売業者は、厚生労働省及びPMDAと協議し安全性速報を作成する。
③ PMDAは、①の通知及び安全性速報を、安全性速報の情報提供開始後、速やか
にPMDAのホームページに掲載し、PMDAメディナビにて速やかに配信す
る。また、製造販売業者においても同様の情報を速やかに自社等のホームページ
(特定の利用者のみ対象としたものではない場所をいう。)に掲載する。なお、
法第 68 条の2の3の規定により注意事項等情報の届出の対象となる医薬品等に
ついては、製造販売業者は改訂電子添文をPMDAに届け出て、PMDAのホー
ムページに公表する。
④ 製造販売業者は、⑤の情報提供計画に従い、医療機関、薬局等に対し、安全性速
報及び改訂後の注意事項等情報等について、迅速性又は網羅性を目的として、直
接配布、ダイレクトメール、ファックス、電子メール等を使用した情報提供を行
うこと。更に、詳細な情報提供等を目的として、直接面談、オンライン面談、電
話等を実施する。これらの方法は、より効果的に実施するため、組み合わせて行
うこととする。また、当該製品の納入が確認されている医療機関の適切な部署
(医療安全管理者、医薬品安全管理責任者、医療機器安全管理責任者、又は医療
機関の製品情報担当者等の所属する部署)、薬局等に、①の通知日又は製造販売
医療機関の製品情報担当者等の所属する部署)、薬局等に、①の通知日又は製造
販売業者が自主的に情報提供を行うと決定した日から1か月以内に情報が到着
していることを確認する。
⑦ 製造販売業者は、PMDA安全部門(医薬品及び再生医療等製品は医薬品安全対
策第一部又は医薬品安全対策第二部、医療機器は医療機器品質管理・安全対策部
をいう。以下同じ。)と緊急安全性情報の情報提供計画について事前に協議し、
別紙様式1又は別紙様式2の提供計画書をPMDA安全部門に提出する。医療
機関、薬局等への情報提供については、当該情報提供計画に従い実施し、その結
果を別紙様式3又は別紙様式4により、PMDA安全部門に提出する。
⑧ 製造販売業者は、医学、薬学等の関係団体に対して情報提供を行い、会員等への
情報提供の協力及び関係団体のホームページ等への掲載等の効果的な広報手段
での周知を依頼する。また、当該製品を使用する患者団体を把握している場合に
は、当該団体に対しても情報提供を行うことも考慮する。
⑨ 製造販売業者は、厚生労働省からの命令、指示、社内各部門での連絡等に関する
文書、情報提供記録を、当該製品の安全性情報に関する記録を利用しなくなった
日から5年間保存する。
(ただし、生物由来製品:10 年、特定生物由来製品:30
年、特定保守管理医療機器及び設置管理医療機器:15 年、再生医療等製品 10 年、
指定再生医療製品 30 年)
(2)安全性速報(ブルーレター)
① 医薬・生活衛生局医薬安全対策課は、安全性速報の作成及び情報提供について、
製造販売業者に対し、命令、指示を行う場合は、その理由等を記した書面又は電
磁的方法により通知する。
② 製造販売業者は、厚生労働省及びPMDAと協議し安全性速報を作成する。
③ PMDAは、①の通知及び安全性速報を、安全性速報の情報提供開始後、速やか
にPMDAのホームページに掲載し、PMDAメディナビにて速やかに配信す
る。また、製造販売業者においても同様の情報を速やかに自社等のホームページ
(特定の利用者のみ対象としたものではない場所をいう。)に掲載する。なお、
法第 68 条の2の3の規定により注意事項等情報の届出の対象となる医薬品等に
ついては、製造販売業者は改訂電子添文をPMDAに届け出て、PMDAのホー
ムページに公表する。
④ 製造販売業者は、⑤の情報提供計画に従い、医療機関、薬局等に対し、安全性速
報及び改訂後の注意事項等情報等について、迅速性又は網羅性を目的として、直
接配布、ダイレクトメール、ファックス、電子メール等を使用した情報提供を行
うこと。更に、詳細な情報提供等を目的として、直接面談、オンライン面談、電
話等を実施する。これらの方法は、より効果的に実施するため、組み合わせて行
うこととする。また、当該製品の納入が確認されている医療機関の適切な部署
(医療安全管理者、医薬品安全管理責任者、医療機器安全管理責任者、又は医療
機関の製品情報担当者等の所属する部署)、薬局等に、①の通知日又は製造販売